| 発表のポイント |
|---|
|
概要
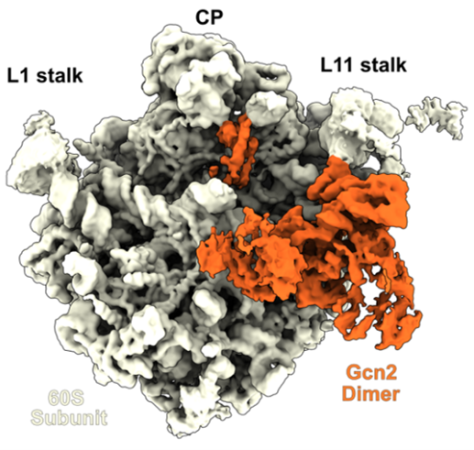
東京大学医科学研究所RNA制御学分野/同大学大学院新領域創成科学研究科 メディカル情報生命専攻の稲田利文教授、李思涵助教、同大学大学院新領域創成科学研究科 メディカル情報生命専攻の夏露(カ ロ)大学院生、ハンブルク大学のDaniel N. Wilson教授、ワシントン大学のHani Zaher教授らの研究グループは、統合的ストレス応答(ISR:Integrated Stress Response、注1)因子Gcn2がリボソーム(注2)の60Sサブユニットに結合することで、Gcn2自身が待機状態に保持されることを報告しました。本研究では、クライオ電子顕微鏡(注3)を用いて、出芽酵母Gcn2と60Sリボソームサブユニットの複合体を可視化することに成功しました。ストレスによって翻訳中のリボソームが停滞し、後続のリボソームと衝突すると、Gcn2は60Sリボソームサブユニットから解離し、衝突リボソーム(注4)に移行してストレス応答を誘導する活性化状態に変化することを明らかにしました。この発見は、翻訳状態によるストレス応答制御に関する新たな知見を提供し、異常翻訳に起因する疾患の理解や、ストレス応答を標的とした創薬研究への貢献が期待されます。本研究成果は、2025年4月8日、米国科学雑誌「PNAS」オンライン版で公開されました。
発表内容
統合的ストレス応答(ISR:Integrated Stress Response)は、翻訳開始因子eIF2のαサブユニット(eIF2α)のリン酸化を介したシグナル伝達経路であり、さまざまなストレスによって共通に惹起される重要な細胞応答です。出芽酵母におけるeIF2αのリン酸化を担う唯一のリン酸化酵素Gcn2は、リボソームの60Sサブユニットに結合することが古くから知られていますが、その構造や機能的意義は未解明のままでした。本研究では、出芽酵母のGcn2-60Sリボソームサブユニット複合体を単離し、その立体構造をクライオ電子顕微鏡解析で決定しました。Gcn2はHisRS-likeドメインとC末端ドメイン(CTD)を介して二量体化し、これらのドメインおよびΨKinaseドメインが60Sサブユニットと相互作用する様子が観察されました(図1)。具体的には、HisRS-likeドメインがL11ストークおよびサルシン-リシンループ(注5)と、ΨKinaseドメインが25SリボソームRNAのヘリックス70と相互作用することがわかりました。C末端ドメインはペプチジルトランスフェラーゼセンター(注6)に位置しており、AサイトおよびPサイト(注7)のトランスファーRNA結合部位と重なることが明らかとなりました。
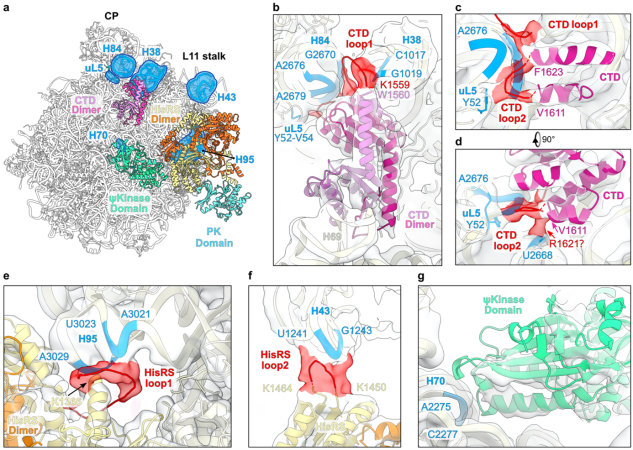
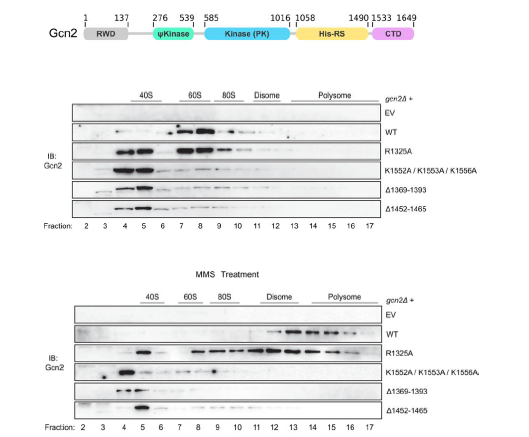
本研究により、長年未解明であったGcn2と60Sリボソームサブユニットとの結合の構造的基盤と、そのストレス応答における役割が明らかとなりました。これらの知見は、翻訳状態によるストレス応答制御機構の理解を深め、異常翻訳に起因する疾患研究や、ストレス応答を標的とした創薬研究への新たなアプローチを提供することが期待されます。
発表者・研究者等情報
東京大学医科学研究所 基礎医科学部門 RNA制御学分野
稲田 利文 教授
李 思涵 助教
兼:東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
大学院新領域創成科学研究科 メディカル情報生命専攻
夏 露 博士課程
論文情報
雑誌名: PNAS(Proceedings of the National Academy of Sciences of the United States of America)題 名: Structure of a Gcn2 dimer in complex with the large 60S ribosomal subunit
著者名: Helge Paternoga#, Lu Xia#, Lyudmila Dimitrova-Paternoga#, Sihan Li#, Liewei L Yan, Malte Oestereich, Sergo Kasvandik, Ankanahalli N. Nanjaraj Urs, Bertrand Beckert, Tanel Tenson, Hani Zaher, Toshifumi Inada*, Daniel N. Wilson*(#共同第一著者 *共同責任著者)
DOI: 10.1073/pnas.2415807122
URL: https://www.pnas.org/doi/10.1073/pnas.2415807122
研究助成
本研究は、稲田利文教授に対する日本医療研究開発機構(AMED)革新的先端研究開発支援事業(CREST 課題番号:JP23gm1110010)、ワクチン開発のための世界トップレベル研究開発拠点の形成事業(UTOPIA 課題番号:JP223fa627001)、日本学術振興会科学研究費助成事業(課題番号:JP19H05281, 21H05277, 22H00401)、武田科学振興財団研究助成金などの支援を受けて行われました。
用語解説
(注1)統合的ストレス応答(ISR:Integrated Stress Response)さまざまなストレスによって引き起こされるシグナル伝達経路である。翻訳開始因子eIF2のαサブユニットのリン酸化により開始し、タンパク質合成を全体的に抑制しながらストレス対処性因子の発現を誘導する一方、過剰のストレス下では細胞死を誘導する。
(注2)リボソーム
大(60S)・小(40S)二つのサブユニットからなり、メッセンジャーRNAにコードされた遺伝暗号であるコドン配列に基づいてアミノ酸を連結させていき、タンパク質を合成する過程(翻訳)を行う分子機械である。リボソームタンパク質とリボソームRNAから構成される巨大な複合体である。
(注3)クライオ電子顕微鏡
液体窒素(-196℃)等により極低温に冷却された試料に対して電子線を照射し、試料を透過した電子線を検出することにより試料の観察を行う顕微鏡。
(注4)衝突リボソーム
翻訳中のリボソームが異常停止し、同一メッセンジャーRNAを翻訳している後続のリボソームと衝突した際に形成される二量体~多量体リボソーム複合体。衝突したリボソームの数に応じてdisome、trisomeなどと呼ばれる。
(注5)L11ストーク、サルシン-リシンループ
リボソーム大サブユニット内部のリボソームRNA上の二つの短い領域であり、タンパク質合成におけるペプチド(アミノ酸が鎖状につながったもの)の伸長に重要なグアノシン三リン酸(GTP)加水分解中心を構成する。
(注6)ペプチジルトランスフェラーゼセンター
リボソーム大サブユニット内部の25SリボソームRNAから構成され、タンパク質合成においてアミノ酸をつなげるペプチド転移反応を触媒する活性中心である。
(注7)Aサイト、Pサイト
リボソーム大サブユニット上で、アミノ酸を運搬するトランスファーRNAが結合する部位(Aサイト)とペプチドが連結したトランスファーRNAが結合する部位(Pサイト)。
(注8)メタンスルホン酸メチル(MMS)
DNA・RNAの損傷を引き起こすアルキル化剤。メッセンジャーRNAをアルキル化し、リボソーム衝突を誘発することが知られている。
問合せ先
〈研究に関するお問い合わせ〉東京大学医科学研究所 基礎医科学部門 RNA制御学分野
教授 稲田 利文(いなだ としふみ)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/basicmedicalsciences/page_00154.html
〈報道に関するお問い合わせ〉
東京大学医科学研究所プロジェクトコーディネーター室(広報)
https://www.ims.u-tokyo.ac.jp/