| 発表のポイント |
|---|
|
発表概要
東京大学大学院医科学研究所分子遺伝医学分野の岡田尚巳教授、笠原優子特任助教と、株式会社カネカ再生・細胞医療研究所の上田恭義所長らによる研究グループは、羊膜間葉系間質細胞(Amnion-derived mesenchymal stromal cells:AMSCs)(注1)を用いたデュシェンヌ型筋ジストロフィー(Duchenne muscular dystrophy:DMD)に対する抗炎症細胞療法の有用性を明らかにしました。DMDは最も重篤な筋疾患であり、ジストロフィー遺伝子変異に加え慢性炎症による病態進行が知られています。そこで研究グループは、モデルマウスを用いてAMSCsを全身反復投与することで、長期にわたる運動機能と心機能の維持効果を立証しました。これにより、AMSCsの炎症制御作用を活用したDMD病態進行の遅延効果が期待されます。
本研究成果は4月27日、国際科学誌「Stem Cell Research & Therapy」に掲載されました。本研究を基盤としたDMDに対する新たな抗炎症細胞療法として、企業治験が行われています。
発表内容
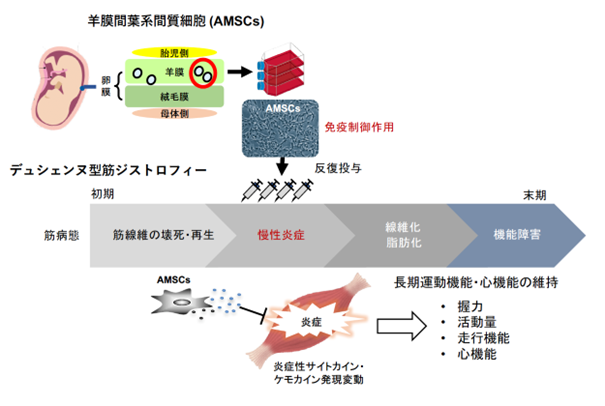
〈研究の背景〉デュシェンヌ型筋ジストロフィー(DMD)は、筋疾患の中でも最も発症頻度が高く(およそ1/3,500男児)、ジストロフィン完全欠損により慢性炎症を伴う進行性の筋機能障害を認め、呼吸不全や心筋症に至る重篤な遺伝性疾患です。遺伝子治療などによるジストロフィン回復を目的とした根本治療が有望とされる一方、骨格筋組織における慢性炎症は機能障害を促す要因とされています。ステロイドによる対症療法は、効果の個人差が大きいことや長期服用による副作用の懸念があることから、慢性炎症を標的とする新たな治療法の開発が望まれます。
羊膜間葉系間質細胞(AMSCs)は、骨髄などと比べて組織含有細胞数が非常に多いため、同一ロットからの採取・拡大培養が容易です。また、幼若組織由来であるため細胞増殖能が旺盛で、継代培養においても染色体構造の安定性が高いことが利点として挙げられます。すでに移植片対宿主病(注2)に対する細胞製剤として販売されている骨髄MSCsと類似した免疫制御作用を有することから、研究グループはDMD骨格筋におけるAMSCsの炎症制御作用に着目しました。
〈研究の内容〉
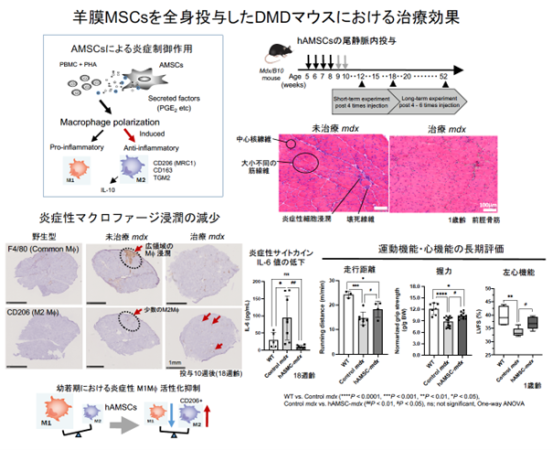
まず、末梢血単核球(PBMC)と共培養したヒト由来AMSCs (hAMSCs)は、プロスタグランジンE2(PGE2)(注3) 産生を介して抗炎症性M2マクロファージ(MΦ)の活性化を促進することを明らかにしました。hAMSCsとDMDモデルmdxマウス由来骨格筋細胞を共培養したところ、これまでに骨髄MSCsによるM2MΦ活性化の際に発現増加が知られているサイトカイン・ケモカインと同じ分泌因子がhAMSCsから誘導されました。hAMSCsにおいてもDMD環境下で、骨髄MSCsと同様の機序でM2MΦの活性化を促す可能性が示唆されました。
そこで、幼若期のmdxマウスへhAMSCsを尾静脈内投与(週1回、4度)し、炎症制御や運動機能における治療効果を検証しました。hAMSCs投与マウスにおける前脛骨筋の病理像は、未治療マウスと比べて細胞浸潤領域が限定的で筋線維間の間隙が狭く、軽症の傾向を示しました。また、未治療マウスで認められるような広範囲なMΦ(F4/80(注4)陽性かつCD206(注5)陰性)の浸潤は、治療マウスでは認められず、多くがM2MΦ(CD206陽性)であることが分かりました。さらに、治療マウスでは炎症による筋線維の壊死に続き再生した中心核線維の割合が減少したことから、hAMSCsによる炎症制御とその後の筋線維壊死の抑制効果が明らかとなりました。この時、治療マウスの横隔膜ではインターロイキン(IL)-1受容体アンタゴニスト(IL-1Ra)(注6)、前脛骨筋ではTIMP-1(Tissue inhibitor of metalloproteinase-1)(注7)の発現が増加し、逆にインターロイキン(IL)-6(注8)値が減少することから、治療マウス骨格筋における炎症制御や組織修復に伴う微小環境の変動が認められました。
さらに、治療マウスはhAMSCs投与4週後から40週以上経過しても握力が維持されており、長期にわたる運動機能の維持効果を示しました。次に、ホイール回転数による自発運動量を測定したところ、治療マウスの走行速度は未治療マウスと同じ程度でしたが、1日あたりの走行距離と夜間の活動量が増加していました。治療マウスは、未治療マウスと比べて1分あたりの持続走行距離が長いことから、走行の持久力が有意に改善していることが明らかになりました。
以上、研究グループはMSCsの炎症制御作用を活用した細胞移植の基盤研究を推進する中で、hAMSCsを投与したDMDマウスにおいて、病態緩和、炎症の鎮静化、運動機能における治療効果を初めて立証しました。
〈今後の展望〉
hAMSCsを活用することで、DMD病態進行を遅延させる新たな細胞治療法の開発が期待されます。
〈関連のプレスリリース〉
「カネカ「ヒト(同種)羊膜由来間葉系幹細胞」によるデュシェンヌ型筋ジストロフィー治験を開始」(2023/7/28)
「カネカ「ヒト(同種)羊膜由来間葉系幹細胞」によるデュシェンヌ型筋ジストロフィー治験を開始」(2023/7/28)
https://www.kaneka.co.jp/topics/news/2023/nr2307281.html
「Novel Stem Cell Transplantation Strategy to Treat Duchenne Muscular Dystrophy」(2023/8/16)
https://www.ims.u-tokyo.ac.jp/imsut/en/research/papers/page_00030.html
「Novel Stem Cell Transplantation Strategy to Treat Duchenne Muscular Dystrophy」(2023/8/16)
https://www.ims.u-tokyo.ac.jp/imsut/en/research/papers/page_00030.html
発表者
東京大学医科学研究所
遺伝子・細胞治療センター 分子遺伝医学分野
岡田 尚巳(教授)
笠原 優子(特任助教)
垣内 祐子(学術専門職員)
附属病院 検査部/循環器内科
木村 公一(特任講師)
株式会社カネカ
再生・細胞医療研究所
上田 恭義(研究所長・執行役員)
中石 智之(基幹研究員)
林 真広(主任研究員)
山口 翔(主任研究員)
中山 宗哉
日本医科大学
共同研究施設 臨床系研究室
仁藤 智香子(教授)
論文情報
〈雑誌〉Stem Cell Research & Therapy〈題名〉Immunomodulatory amnion‑derived mesenchymal stromal cells preserve muscle
function in a mouse model of Duchenne muscular dystrophy
〈著者〉Yuko Nitahara‑Kasahara*,Soya Nakayama,Koichi Kimura,Sho Yamaguchi,
Yuko Kakiuchi,Chikako Nito,Masahiro Hayashi,Tomoyuki Nakaishi,Yasuyoshi Ueda and Takashi Okada*
*責任著者
〈DOI〉10.1186/s13287-023-03337-0
〈URL〉https://stemcellres.biomedcentral.com/articles/10.1186/s13287-023-03337-0
研究助成
本研究は、国立研究開発法人科学技術振興機構(JST)の産学共同実用化開発事業(NexTEP)「羊膜間葉系幹細胞の細胞製剤化と治療応用(JPMJTT14N3)」の一貫で行われているもので、科研費基盤研究(B)「アデノ随伴ウイルスベクター基盤技術開発と脳神経疾患に対する遺伝子細胞療法(20H03788)」、科研費基盤研究(C)「筋ジストロフィーに対する機能強化羊膜間葉系幹細胞を用いた抗炎症療法と評価系の構築(22K06921)」、「羊膜間葉系幹細胞由来エクソソームを利用した次世代型脳梗塞治療法の確立(21K09163)」、「病態進行の完全抑制を目指した多角的集学的アプローチによる筋ジストロフィー治療開発(23K06905)」の助成を受けたものです。
用語解説
(注1)羊膜間葉系間質細胞(Amnion-derived mesenchymal stromal cells:AMSCs)間葉系間質細胞 (mesenchymal stromal cells:MSCs)は、体性幹細胞の一つで生体の様々な組織に存在する。骨、脂肪、歯髄、胎児付属物などから採取されるMSCsは共通の細胞表面マーカー(CD73、CD90、CD105陽性、CD34、CD45、CD14またはCD11b、CD79aまたは CD19、human leucocyte antigen (HLA)-class II陰性)を示し、多分化能 (骨芽細胞、脂肪細胞、軟骨細胞、神経細胞、筋細胞など) や多様な免疫制御作用を示すことから、移植ツールとして注目され、すでに骨髄MSCsは臨床で用いられている。羊膜間葉系間質細胞は、出産時の胎盤から分離した羊膜由来MSCsのこと。
(注2)移植片対宿主病
造血幹細胞移植の際、ドナー由来のT細胞が活性化され炎症性サイトカインを放出し、レシピエントの正常組織を攻撃して引き起こされる合併症のこと。
(注3)プロスタグランジンE2:PGE2
生理機能脂質の1つで、炎症関連メディエイターとして知られる。受容体にはEP1、EP2、EP3、EP4の4種類があり、マクロファージや樹状細胞ではEP4を介して免疫抑制機能を示す。
(注4)F4/80
膜タンパク質で成熟マクロファージの主要なマーカー。
(注5)CD206
I型膜受容体(膜貫通糖タンパク質)で、食細胞受容体としてM2マクロファージと樹状細胞に発現し、真菌、細菌、およびウイルスが共有するさまざまなマンノシル化リガンドに結合することで、糖タンパク質のエンドサイトーシスを媒介する。
(注6)インターロイキン(IL)-1受容体アンタゴニスト
炎症性サイトカインIL-1の生理活性を調節する分子。IL-1受容体IとIIの両方に結合するが、アゴニスト活性はなく、体内に存在するIL-1インヒビターとして知られる。
(注7)TIMP (Tissue inhibitor of metalloproteinase) -1
マトリックスメタロプロテアーゼ(MMPs:matrix metalloproteinases)の阻害剤であるTIMPファミリーに属する。TIMP-1は、多くのMMP活性を阻害して細胞増殖・生存に関与する。TIMPsとMMPsのバランスが維持されることで、細胞外マトリックスの恒常性とリモデリングが正常に保たれる。
(注8)インターロイキン(IL)-6
炎症性サイトカインおよび抗炎症性サイトカインの両面で作用するインターロイキン。リンパ球および単球分化に作用し、B細胞がIg分泌細胞に最終分化するために不可欠とされる。また、IL-6過剰産生は、炎症性サイトカインの急激な増加によって引き起こされるサイトカインストームに関与する。
問合せ先
〈研究に関する問合せ〉
東京大学医科学研究所 遺伝子・細胞治療センター 分子遺伝医学分野
教授 岡田 尚巳(おかだ たかし)
〈報道に関する問合せ〉
東京大学医科学研究所 プロジェクトコーディネーター室(広報)