| 発表のポイント |
|---|
|
発表概要
東京大学医科学研究所 癌防御シグナル分野 李丹特任研究員(現ハーバード大学研究員)と、同分野の中西真教授、同大学大学院医学系研究科 戸田達史教授、金沢大学がん進展制御研究所の城村由和教授らによる研究グループは、神経細胞内の異常タンパク質凝集の分解を誘導する新たな酵素を同定しました。これまでミスフォールド(注1)したタンパク質を特異的にユビキチン化(注2)し、分解誘導する酵素はいくつか知られていましたが、神経細胞において神経変性疾患の原因となるミスフォールドタンパク質のユビキチン化・分解誘導酵素についてはよく分かっていませんでした。今回、LONRF2酵素が、筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS, 注3)の原因となる変性hnRNPやTDP43タンパク質を選択的にユビキチン化することを見出しました。Lonrf2ノックアウトマウスは、加齢依存的なALS様症状を示し、病理学的解析から脊髄や大脳皮質の運動神経にTDP43等のタンパク質凝集体によると考えられる神経変性や神経細胞死を認めました。また特発性ALS患者さんの中に、LONRF2の機能を完全に喪失したバリアント遺伝子を同定しました。最も重要なことに、ALS患者さん由来のiPS細胞から分化誘導した運動神経にLonrf2遺伝子を導入すると、運動神経に見られる異常が改善することが分かりました。以上のことから、Lonrf2はALSなどの神経変性疾患に対する新たな治療法の確立に有用である可能性が示されました。本研究成果は7月20日、国際科学誌「Nature Aging」に掲載されました。
発表内容
〈研究の背景〉多くの加齢性疾患はタンパク質のミスフォールディングと関連しており、またある種の環境ストレスは成熟タンパク質のミスフォールディングを誘発します。これを回避するために、細胞は翻訳制御、分子シャペロン活性、プロテアソームやオートファジーによるタンパク質分解などのタンパク質品質管理(PQC)システムを備えています。多くの神経変性疾患に共通する特徴は、ミスフォールドタンパク質の蓄積であることから、これら疾患の神経細胞ではPQCシステムの破綻が予想されます。とりわけ、ミスフォールドタンパク質を選択的に分解する機構は神経変性疾患発症に重要と考えられていますが、有糸分裂後の細胞で主に機能するシステムについてはほとんど理解されていません。
〈研究内容〉
本研究グループは、有糸分裂から有糸分裂後へのスイッチのモデルとして老化細胞を用い、Lonrf2遺伝子の発現が老化誘導後に誘導されることを見出しました。LONRFファミリーはRINGフィンガードメイン(注4)を持つユビキチン化酵素で、LONRF1-3から構成されていますが、その酵素的、生理的機能、病態における役割は未解明でした。LONRF2は主に細胞質と核に存在し、老化細胞に過剰発現させると細胞内のタンパク質凝集体が減少し、発現抑制すると凝集体が増加します。
個体内においては、Lonrf2は神経細胞で主に発現しています。老化したマウスの脳から得られたデータセットの単一細胞解析では、Lonrf2は主に成熟神経細胞で発現していました。TDP-43やhnRNP M1を含む神経細胞内のミスフォールディングタンパク質は、ALSやFTLD2のような多くの神経変性疾患と関連しています。野生型LONRF2は、A549細胞においてタンパク質変性下でのみhnRNP M1とTDP-43の両方をユビキチン化しました。またこの活性はLonSBやRINGドメインを欠失した変異体では見られませんでした。
次にLonrf2ノックアウトマウス(Lonrf2-/-)を作製して解析を行いました。Lonrf2-/-マウスは、正常なメンデル比で明らかな発育異常なしに生まれ、体重は野生型同腹子と同じで、18ヶ月齢まで正常に見えました。しかしながら、Lonrf2-/-マウスは雌雄ともに21ヵ月齢までに野生型と比較して年齢依存性の握力の低下や、ロータロッド試験(注5)での運動学習障害などの運動障害を発症し、短い寿命を示しました。
脊髄の免疫組織化学的解析から、Lonrf2-/-マウスのコリンアセチルトランスフェラーゼ陽性神経細胞の数は、生後21ヶ月では野生型と比較して有意に減少していました。またTDP43凝集体陽性の神経細胞数も増加していました。筋萎縮と神経筋接合部の欠損はALS患者の典型的な特徴の一つです。Lonrf2-/-マウスの筋線維径の分布は、野生型と比較して小径にシフトしており、脱神経したアセチルコリン受容体クラスターの数が増加していました。
これらの結果は、Lonrf2-/-マウスが運動神経変性や、筋萎縮と神経筋接合部欠損を示しており、LONRF2が生体内でTDP-43のようなミスフォールディングタンパク質を分解することを示唆しています。
運動神経に見られる異常は、Lonrf2-/-マウス由来のiPS細胞を運動神経に分化させても観察され、Lonrf2を発現させると回復しました。重要なことに、ALS患者由来のiPS細胞を運動神経細胞に分化させると正常に比較して神経突起の短小化を認めますが、この異常もLonrf2を発現することで改善しました。最後に、特発性ALS患者さんにおいてLONRF2のミスフォールドタンパク質をユビキチン化する活性を喪失したバリアント遺伝子を同定しました。
〈今後の展望〉
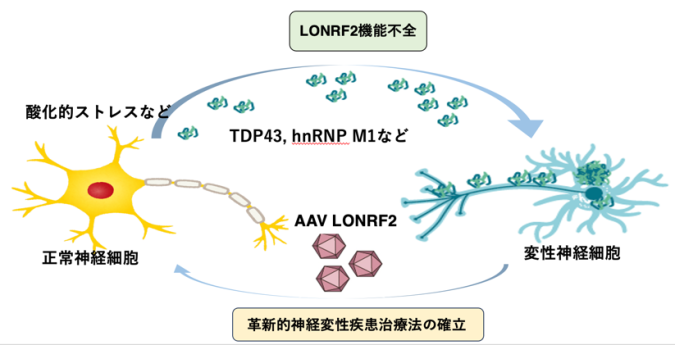
今回の研究結果は、LONRF2がALSなどの神経変性疾患の発症に関わっている可能性を示唆しており、今後Lonrf2を用いた全く新しい革新的な神経変性疾患治療法に有用であると考えられます(下図)。
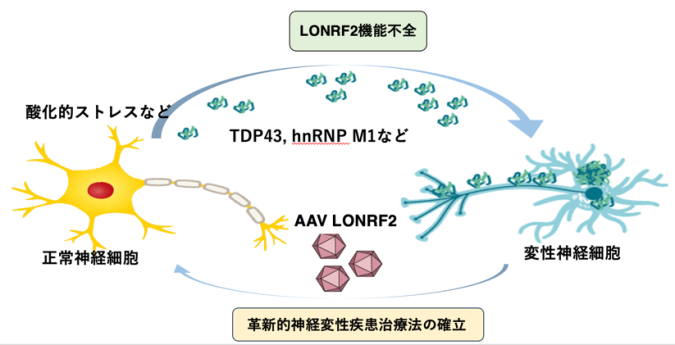
LONRF2機能不全により、さまざまなミスフォールドタンパク質が神経細胞内に蓄積して神経細胞が変性する。変性した神経細胞にAAV-Lonrf2を発現することで、蓄積したミスフォールドタンパク質が除去されて神経細胞が正常に近づくと予想される。
発表者
東京大学
医科学研究所
中西 真(教授)
李 丹(ハーバード大学研究員)<研究当時:東京大学医科学研究所 特任研究員>
山梨 裕司(教授)
山梨 裕司(教授)
中井 謙太(教授)
古川 洋一(教授)
岡田 尚巳(教授)
岡田 尚巳(教授)
大学院医学系研究科
戸田 達史(教授)
金沢大学がん進展制御研究所
城村 由和(教授)
筑波大学大学院人間総合科学学術院
山﨑 聡(教授)
大阪大学大学院医学系研究科
島田 昌一(教授)
慶應義塾大学医学部生理学教室
岡野 栄之(教授)
論文情報
〈雑誌〉 Nature Aging〈題名〉 LONRF2 is a protein quality control ubiquitin-ligase whose deficiency causes late-onset neurological deficits
〈著者〉 Dan Li, Yoshikazu Johmura*, Satoru Morimoto, Miyuki Doi, Keiko Nakanishi, Manabu Ozawa, Yuji Tsunekawa, Akane Inoue-Yamauchi, Hiroya Naruse, Takashi Matsukawa, Yukio Takeshita, Naoki Suzuki, Masashi Aoki, Ayumi Nishiyama, Xin Zeng, Chieko Konishi, Narumi Suzuki, Atsuya Nishiyama, Alexander Stephen Harris, Mariko Morita, Kiyoshi Yamaguchi, Yoichi Furukawa, Kenta Nakai, Shoji Tsuji, Satoshi Yamazaki, Yuji Yamanashi, Shoichi Shimada, Takashi Okada, Hideyuki Okano, Tatsushi Toda, Makoto Nakanishi*
*責任著者
〈DOI〉 10.1038/s43587-023-00464-4
〈URL〉 https://www.nature.com/articles/s43587-023-00464-4
研究助成
本研究は、AMED革新的先端研究開発支援事業「神経細胞におけるミスフォールドタンパク質分解機構と神経変性疾患における役割の解明」、AMEDムーンショット型研究開発事業「炎症誘発細胞除去による100歳を目指した健康寿命延伸医療の実現」、AMED再生医療実現拠点ネットワークプログラム「神経疾患特異的iPS細胞を活用した病態解明と新規治療法の創出を目指した研究」、AMED再生医療実現拠点ネットワークプログラム「iPS細胞を用いた希少疾患の研究促進のための研究者マッチング」、AMED難治性疾患実用化研究事業「筋萎縮性側索硬化症克服のためのDeep-Phenotyping の統合解析を通じた治療開発研究」、AMED脳とこころの研究推進プログラム精神・神経疾患メカニズム解明プロジェクト「孤発性筋萎縮性側索硬化症の双方向トランスレーショナル研究による病態介入標的の同定と核酸医薬の開発研究」の支援とJSPS 科研費 JP20H00485,JP21H05278の助成を受けたものです。
用語解説
(注1)ミスフォールド:
タンパク質が折りたたまれる過程で特定の立体構造をとらず、生体内で正しい機能や役割を果たせなくなること。
(注2)ユビキチン化:
ユビキチン化はタンパク質修飾の一種で、ユビキチンリガーゼなどの働きによりユビキチンタンパク質がイソペプチド結合で基質タンパク質に付加される。ポリユビキチン修飾されたタンパク質は、プロテアソームにより認識されタンパク質分解を受ける。
(注3)筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS):
体を動かすのに必要な筋肉が徐々にやせていき、力が弱くなって思うように動かせなくなる病気。
(注4) RINGフィンガードメイン:
ユビキチンを、E2酵素から基質タンパク質に転移させる、RING型E3ユビキチンリガーゼに特徴的なドメイン。
(注5) ロータロッド試験:
げっ歯類における協調運動と運動学習を測定するテスト。回転する棒の上にマウスをのせて徐々に速度を上げ、マウスが落下するまでの時間を測定する。
タンパク質が折りたたまれる過程で特定の立体構造をとらず、生体内で正しい機能や役割を果たせなくなること。
(注2)ユビキチン化:
ユビキチン化はタンパク質修飾の一種で、ユビキチンリガーゼなどの働きによりユビキチンタンパク質がイソペプチド結合で基質タンパク質に付加される。ポリユビキチン修飾されたタンパク質は、プロテアソームにより認識されタンパク質分解を受ける。
(注3)筋萎縮性側索硬化症(amyotrophic lateral sclerosis:ALS):
体を動かすのに必要な筋肉が徐々にやせていき、力が弱くなって思うように動かせなくなる病気。
(注4) RINGフィンガードメイン:
ユビキチンを、E2酵素から基質タンパク質に転移させる、RING型E3ユビキチンリガーゼに特徴的なドメイン。
(注5) ロータロッド試験:
げっ歯類における協調運動と運動学習を測定するテスト。回転する棒の上にマウスをのせて徐々に速度を上げ、マウスが落下するまでの時間を測定する。
問合せ先
〈研究に関する問合せ〉
東京大学医科学研究所
教授 中西 真(なかにし まこと)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/cancerbiology/section04.html
金沢大学がん進展制御研究所
教授 城村 由和(じょうむら よしかず)
〈報道に関する問合せ〉
東京大学医科学研究所 プロジェクトコーディネーター室(広報)