| 発表のポイント |
|---|
|
発表概要
細胞が増殖因子で刺激されると、蛋白質リン酸化酵素であるERK(注1)が活性化して、初期応答遺伝子(IEG;注2)と呼ばれる一群の遺伝子(FosやJun等)の発現が迅速に誘導され、最終的に細胞増殖が導かれます。また、この様な細胞内情報伝達の異常が、発癌や癌の進展にも深く関与することが知られています。近年、増殖刺激に伴うIEGの迅速な発現は、主にRNAポリメラーゼII (Pol-II;注3)による転写伸長反応段階での制御、即ち「遺伝子DNA上で一時停止した状態にあるPol-IIが、増殖刺激によって再び転写を再開するプロセス」で制御されていることが明らかになってきました。しかしながら、このプロセスにおけるERKの役割は全く分かっていませんでした。今回、東京大学医科学研究所分子シグナル制御分野の武川睦寛教授、久保田裕二講師、大江星菜大学院生らの研究グループは、ERKによってリン酸化される蛋白質分子を網羅的に同定する新たな実験法を開発し、ERKの新たな基質として、NELF-A(Pol-IIと結合して転写伸長を阻害する分子;注4)を同定しました。さらに、増殖因子によって活性化したERKがNELF-Aをリン酸化することで、NELFがPol-IIから解離し、転写の一時停止が速やかに解除されて、IEGの迅速な発現と細胞増殖が導かれていることを発見しました。また、脱リン酸化酵素PP2A(注5)がNELF-Aを効率よく脱リン酸化して、IEGの発現を負に制御する分子であることを見出すとともに、ヒト癌ではPP2A阻害分子(SETやCIP2A)の異常な高発現によってPP2A活性が低下しており、NELF-Aのリン酸化が亢進して、IEGの発現と癌の増殖・進展が導かれていることを明らかにしました。
本研究により、細胞増殖を制御する根本的な分子機構の詳細が明らかになるとともに、肺・大腸・膵癌など、患者数の多い癌で高率に認められるPP2A阻害分子の異常な高発現が、発癌過程と癌の進展に果たす役割が明らかとなりました。今後、今回の研究成果を応用した新たな癌治療薬の開発が期待されます。
本成果は2022年12月3日、英国科学雑誌「Nature Communications」に掲載されました。なお本研究は、東京大学医科学研究所の古川洋一教授、尾山大明准教授らとの共同研究として行われました。
発表内容
ゲノムDNA上にコードされた遺伝子が機能するには、まずDNAからmRNAを転写する必要があります。一般的な遺伝子の転写は、RNAポリメラーゼII(Pol-II)が担っており、各遺伝子の転写開始点に結合したPol-IIが、DNAの二重らせんを部分的に解きながら進んで行き、完全長のmRNAを合成することが知られています(図1)。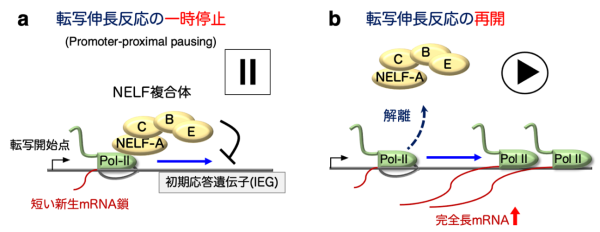
図1: RNA ポリメラーゼ II の一時停止とその解除による転写伸長反応の制御
a. 無刺激状態の細胞では、 NELF複合体(NELF-A, B, C/D, E)はPol-IIと結合し、初期応答遺伝子の転写開始点から下流20~60塩基の地点でPol-IIを停留させ、転写伸長反応を一時的に停止させている(Promoter-proximal pausing : PPP) 。
b. 細胞を増殖因子で刺激すると、NELF複合体がPol-IIから解離してPPPが解除され、転写伸長反応が再開して、初期応答遺伝子が速やかに発現する。
ヒトを含む高等生物の転写は、①Pol-IIによる転写開始、②転写開始点近傍でのPol-IIの一時停止、③刺激による一時停止の解除、④転写伸長、⑤終結、という複数の段階を経て成し遂げられています。これらの内、転写開始と終結に関しては、その分子機構がよく分かっていますが、一方で「転写の一時停止とその解除」を制御するメカニズムには不明な点が多く残されています。
近年、この過程にNELF (negative elongation factor)と呼ばれる蛋白質複合体が関与することが示されました。NELFはPol-IIと直接結合して転写を停止させる機能を持つ複合体です。遺伝子DNA上で転写が始まると、NELFは直ちにPol-IIと結合して、転写開始点の近傍でPol-IIによる転写伸長を停止させてしまいます(この現象をPromoter-Proximal Pausing: PPPと呼びます;注6)。無刺激状態の細胞では、NELFはPol-IIと結合したままとなり、Pol-IIによる転写が「一時停止」した状態で保たれ、完結しませんが、細胞に刺激が加わると、NELFがPol-IIから解離して転写が再開し、mRNA合成が完了して遺伝子発現が誘発されます。
興味深いことに、この様な転写伸長反応レベルでの遺伝子発現制御は、増殖刺激に応答して速やかに誘導される初期応答遺伝子群 [immediate-early genes (IEG); FosやJun等] の発現調節に極めて重要であることが示されています。即ち、NELFを介した「転写伸長反応の一時停止とその解除」は、外部刺激に応じて遺伝子発現を迅速かつ同期的に亢進させる機構であり、生命が外部環境変化に速やかに応答する上で極めて重要です。実際に、増殖刺激後に起こるIEGの迅速な発現は細胞増殖に必須であり、発癌にも深く関与します。しかし、増殖因子がどの様にしてNELFをPol-IIから解離させ、IEGの転写伸長を再開させるのか、そのメカニズムは不明でした。
細胞の増殖は、ERK経路(Raf−MEK−ERK)と呼ばれるシグナル伝達機構によって厳密に制御されています。細胞が増殖因子を受容すると、タンパク質リン酸化酵素ERKが活性化して、最終的にIEGの発現を導きます。従って、IEGの発現には、ERKとNELFの両方が関与しますが、両者がどのようにして協調し、IEGの転写伸長と増殖を調節しているのか、その分子機構は全く分かっていませんでした。
今回、研究グループは、ERKの新規基質分子としてNELF-A(NELF複合体の主要な構成因子)を同定し、さらに、増殖因子によって活性化したERKがNELF-Aをリン酸化することでNELFがPol-IIから解離すること、またその結果、転写伸長が再開してIEGの発現と細胞増殖が導かれていることを発見しました。加えて、脱リン酸化酵素PP2A が、ERKによるNELF-Aのリン酸化を効率よく抑制する分子であることを見出すとともに、ヒト癌ではPP2A阻害分子(SETやCIP2A)の異常な高発現によってPP2Aの機能が阻害されており、NELF-Aのリン酸化亢進とIEGの発現増強が誘発され、癌の増殖・進展が導かれていることを明らかにしました。
まず研究チームは、ERKによってリン酸化される基質分子を網羅的に同定する新たな手法(酵母3-hybrid法)を開発して、ヒトcDNA発現ライブラリーのスクリーニングを行い、ERKの未知基質分子としてNELF-Aを同定することに成功しました。実際にヒト培養細胞を用いた実験から、増殖因子によって活性化したERKが、NELF-A分子内の4箇所のSer/Thr残基を速やかにリン酸化することを確認しました(図2a, b)。
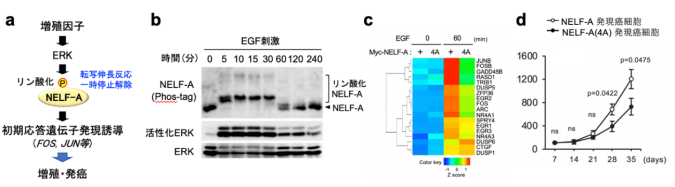
図2: ERKによるNELF-Aのリン酸化はPol-IIのPPPを解除し、初期応答遺伝子の発現を促す
a. 増殖因子によって活性化されたERKはNELF-Aをリン酸化して、転写の一時停止を解除し初期応答遺伝子の迅速な発現を導く。
b. 上皮増殖因子(EGF)刺激によるNELF-Aのリン酸化。ERK活性依存的にNELF-Aのリン酸化(バンドシフト)が観察される。
c. 網羅的遺伝子発現解析。リン酸化不応型NELF-A(4A)変異体を発現する細胞では、 EGF刺激後も転写の一時停止が解除されないため、野生型細胞と比較して、初期応答遺伝子群の発現量が有意に低下した。
d. 免疫不全マウスへのヒト癌細胞移植実験。NELF-A(4A)発現癌細胞では、初期応答遺伝子の発現が低下しており、増殖能・腫瘍形成能も抑制された。
次にERKによるNELF-Aリン酸化の意義を解明するため、リン酸化されないNELF-A(4A)変異体を発現する細胞を樹立して、増殖因子刺激後に起こる遺伝子発現変動を網羅的に解析したところ、NELF-A(4A)発現細胞では、野生型細胞と比較して、IEG(Fos/Jun等)の発現が有意に抑制されていることを見出しました(図2c)。さらに、この原因を解析した結果、NELF-A(4A)変異体は、ERKによるリン酸化が起こらないため、増殖因子刺激後もPol-IIから解離せず、Pol-IIによるIEGの転写伸長を抑制し続けていることが分かりました。また、その結果、NELF-A(4A)発現細胞では、増殖関連分子(Cyclin D等)の発現や、細胞増殖が阻害されていることを見出しました(図2d)。即ち、増殖因子によって活性化したERKがNELF-Aをリン酸化することで、NELFがPol-IIから解離して「転写伸長の一時停止」が解除され、IEGの迅速な発現と細胞増殖が導かれていることが明らかとなりました(図3左)。
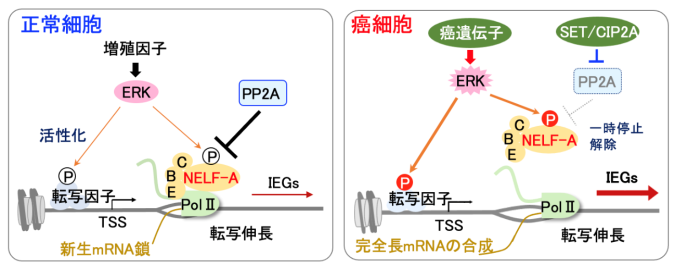
図3: PP2A阻害分子の異常な高発現はNELF-Aのリン酸化を増強し、癌の進展を促進する
(左)正常細胞では、増殖因子刺激により活性化したERKが、NELF-Aをリン酸化してPol-IIの一時停止を解除することで転写伸長反応を促進し、初期応答遺伝子群(IEG)の迅速な発現と細胞増殖を導く。NELF-Aのリン酸化はERKとPP2Aのバランスにより厳密に制御されている。
(右)発癌過程で癌遺伝子に変異が入り、ERKが恒常的かつ中程度に活性化しても、PP2AがNELF-Aを効率よく脱リン酸化するため、それだけでは転写の一時停止は解除されず、IEGの発現は抑制されている。しかし多くの癌では、PP2A阻害分子(SET/CIP2A) の異常な高発現によってPP2A活性が低下しており、NELF-Aのリン酸化が亢進してIEGの発現および癌の進展を導く。
多くの癌細胞では、様々な癌遺伝子の作用によりERKが恒常的に活性化していることから、その基質であるNELF-Aも常にリン酸化されている可能性が示唆されます。この可能性を検証するため、様々な癌細胞におけるNELF-Aのリン酸化状態をモニターしたところ、予想に反して、多くの培養癌細胞では、ERKが恒常的に活性化しているにも関わらずNELF-Aは殆どリン酸化されておらず、IEGの発現も認められないことが分かりました。
そこでこの原因について解析した結果、NELF-Aは、ERKのみならず、脱リン酸化酵素PP2Aに対しても極めて良好な基質となっており、ERKによるNELF-Aのリン酸化は、PP2Aによって速やかに除去されていることが分かりました。即ち、細胞内におけるNELF-Aのリン酸化状態はERKとPP2Aのバランスによって厳密に制御されており、PP2Aが正常な癌細胞では、癌遺伝子によってERK活性がある程度亢進してもNELF-Aのリン酸化は起こらず、IEGの発現も低く保たれていることが分かりました。
興味深いことに、ヒト癌ではPP2A阻害分子(SETやCIP2A)の異常な高発現が報告されています。そこで実際に様々な癌の臨床検体を解析したところ、膵/大腸/肺癌および悪性黒色腫などで極めて高率(患者の70-90%以上)にPP2A阻害分子の高発現が確認されました。さらにこの様な癌組織ではIEGの発現も有意に亢進しており、腫瘍が増大して患者の生命予後を悪化させていることが分かりました(図3右)。また実際に、癌細胞内にPP2A阻害分子を発現させると、それだけで十分にNELF-Aのリン酸化が誘発されて、IEGが強く発現し、癌の増殖能が亢進することを実験的に確認しました。
これまで、ERKがIEGの発現を導くメカニズムとして、主にERKが転写因子をリン酸化してその転写活性を亢進させること、即ち「転写開始」段階での制御のみが注目されてきました。しかしながら近年、増殖刺激後に起こるIEGの迅速かつ同期的な発現誘導には、転写開始段階よりも、むしろ転写伸長反応段階での制御(即ち、転写の一時停止と刺激によるその解除)が重要であることが明らかとなってきました。しかし、ERKがどの様にして、遺伝子DNA上で一時停止したPol-IIの転写伸長反応を再開させるのか、その分子機構に関しては全く知見がありませんでした。
本研究により、新たなERK基質分子NELF-Aが同定されると共に、ERKがNELF-Aのリン酸化を介してPol-IIの転写伸長反応を再開させ、これによってIEGの迅速な発現と細胞増殖が導かれていることが明らかとなりました。さらにPP2Aが、細胞内でNELF-Aを積極的に脱リン酸化して、IEGの発現を抑制する分子であることも明らかとなりました。PP2AによるNELF-Aの効率的脱リン酸化は、正常細胞においては、増殖因子刺激後に起こるIEG発現の量と持続時間を適切に制限するメカニズムであり、一方、癌細胞においては、ERKの異常活性化に伴うNELF-Aのリン酸化とIEGの発現誘導を打ち消し、癌の進展を抑える役割を担っていると考えられます。しかしながら、多くのヒト癌では、PP2A阻害分子(SET/CIP2A)が極めて高率に高発現しており、癌細胞内のPP2A活性が低下して、NELF-Aのリン酸化とIEGの発現が異常に亢進し、癌細胞の増殖を促していることが明らかとなりました。今後、今回の研究成果を応用した新たな癌治療薬の開発が期待されます。
発表雑誌
雑誌名:Nature Communications 13, 7476 (2022)論文タイトル:ERK-mediated NELF-A phosphorylation promotes transcription elongation of immediate-early genes by releasing promoter-proximal pausing of RNA polymerase II
著者:
Seina Ohe, Yuji Kubota, Kiyoshi Yamaguchi, Yusuke Takagi, Junichiro Nashimoto, Hiroko Kozuka-Hata, Masaaki Oyama, Yoichi Furukawa, and *Mutsuhiro Takekawa(*責任著者)
DOI:10.1038/s41467-022-35230-4
URL: https://www.nature.com/articles/s41467-022-35230-4
6.問い合わせ先:
東京大学医科学研究所 分子シグナル制御分野
教授 武川睦寛(たけかわ むつひろ)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/basicmedicalsciences/section02.html
<報道に関するお問い合わせ>
東京大学医科学研究所 国際学術連携室(広報)
https://www.ims.u-tokyo.ac.jp/imsut/jp/
用語解説
(注1) ERK増殖因子刺激に応答して活性化され、細胞増殖や分化を導く蛋白質リン酸化酵素(キナーゼ)。MEKやRafとともにERK経路(Raf-MEK-ERK)と呼ばれる細胞内シグナル伝達経路を構成する。RafやMEK、更にその上流の分子(Ras、EGFR等)はいずれも癌遺伝子であり、ERK経路を異常に活性化して発癌を導く。
(注2)初期応答遺伝子(immediate early genes; IEG)
増殖因子刺激などに反応して早期(15~60分)に転写誘導される遺伝子群の総称。IEGの多くはそれ自身が転写因子(Fos、Jun、Mycなど)であり、さらにサイクリンD遺伝子などの発現を導いて、細胞周期進行、細胞増殖、腫瘍血管新生、癌転移などに寄与する。
(注3)RNAポリメラーゼII (Pol-II)
真核生物の核内で、DNA を鋳型として mRNA を合成する転写反応を触媒する 酵素。
(注4) NELF-A (negative elongation factor-A)
遺伝子DNA上で転写中のPol-IIと直接結合して、Pol-IIの転写伸長反応を停止させるNELF複合体の中心的なサブユニット。4つのサブユニット[NELF-A, B , C(またはD), E]からなるNELF複合体の中で、NELF-AがPol-IIと直接結合することが示されている。
(注5) PP2A
蛋白質のセリンまたはスレオニン残基のリン酸化を除去する脱リン酸化酵素(ホスファターゼ)の一つ。がん抑制的に機能するが、多くのがん細胞において活性低下が認められる。
(注6) Promoter-proximal pausing(PPP)
遺伝子DNA上でPol-IIによる転写が始まると、その直後にNELFが結合して、Pol-IIが転写開始点から約20-60塩基下流で停留する現象。Pol-IIは、標的遺伝子のごく短い新生RNA鎖を合成した状態で停止している。増殖因子刺激などにより、NELFがPol-IIから解離すると、転写伸長反応が再開し、完全長mRNAが合成されて遺伝子が発現する。
