| 発表のポイント |
|---|
|
概要
今、世界は、新型コロナウイルス感染症(COVID-19)の未曾有の脅威に直面しています。2020年5月19日現在で、全世界で480万人の方が感染し、30万人以上の方が命を落としており、今後の展開については全く予断を許しません。この脅威を克服するためには、全世界で協力して、本感染症をさまざまな側面から科学的に解明し、これに基づいた正確な診断法、重症化の予測、有効な治療薬およびワクチンの開発が火急の課題となっています。今回、慶應義塾大学、東京医科歯科大学、大阪大学、東京大学医科学研究所、国立研究開発法人国立国際医療研究センター、東京工業大学、北里大学、京都大学に所属する感染症学、ウイルス学、分子遺伝学、ゲノム医学、計算科学を含む、異分野の専門家からなる共同研究グループが、「コロナ制圧タスクフォース」を立ち上げました。
新型コロナウイルス感染症の最大の脅威の一つは、重症患者のうちの多くが短期間のうちに急に重篤化することです。そして、その救命のためには、大きな医療リソースを必要とするということです。本タスクフォースでは、最先端のゲノム解析技術を駆使して、新型コロナウイルス感染症が重症化するメカニズムの遺伝学的な基盤を明らかにするとともに、新型コロナウイルス(SARS-CoV-2)に対する有効な粘膜ワクチンの開発を行います。
具体的には、日本人のCOVID-19の人口当たりの死亡者数が欧米諸国に比べ圧倒的に少ない点に注目し、日本人におけるCOVID-19の重症感染者と軽症・無症候感染者を比較することで、日本人特有のCOVID-19重症化に関連する疾患感受性遺伝子の探索を行います。このようにして得られる知見から、今後、COVID-19診療における治療予測を提供するだけでなく、独自の特許技術に基づいて、有効な粘膜ワクチンの開発を目指します。
本研究は、国立研究開発法人日本医療研究開発機構によってサポートされます。
コロナ制圧タスクフォースとは
今、世界は、新型コロナウイルス(SARS-CoV-2)(注1)感染症(COVID-19)(注2)による未曾有の脅威に直面しています。WHOをはじめ、感染症・公衆衛生の専門家の見解によれば、このパンデミックは2年から3年続き、この秋冬にも流行の第2波が到来することは必至の状況とも言われています。このような100年に一度の事態に当たって、私達の生活も変更を余儀なくされております。
こうした社会状況をふまえて、私達は「コロナ制圧タスクフォース」を立ち上げることにいたしました。当初は医師、研究者の少人数の仲間による議論でスタートしましたが、我が国を始め全世界で、毎日、多数の方々が亡くなられておられる現状を前にして、「医学」「科学」という観点から社会に貢献することはできないかと、多数の人々が集まり、その輪が広がっています。
ICUの最前線で診療に当たられている方々、大学病院で働いておられる医療スタッフ、地域医療の最前線を担う開業医の方々、免疫学者、感染症学者、あるいはまた、医学の専門家ではないけれどもこうした活動に共感をもっていただける一般の方々が、チームを作って新型コロナウイスル感染症をより理解し、合理的な予防や治療に資する、「客観的な」研究や情報の発信を目指しています。本タスクフォースのミッションは以下のとおりです。
1) できるだけ多数のCOVID-19に罹患した患者の検体(DNA, RNA, 血漿)および臨床情報を集積することにより、国際協調も含めた研究の推進に資すること
2) 臨床検体を用いた基礎的な研究を推進すること
3) ワクチン開発を推進すること
すでに検体の集積は始まっていて、2020年5月19日現在で、10施設で研究の倫理委員会の承認を得て検体集積が始まっており、40施設が倫理委員会の承認を申請しており、間もなく検体の集積が大規模に行われます。今後とも、できるだけ多くの医療機関の参画をお願いしてまいりたいと考えています。最初の具体的な研究目標は、COVID-19の重症化に関わる宿主側(患者側)の因子、とくに遺伝学的な因子を明らかにすることです。なお、研究成果と研究の進捗は定期的に本サイトで更新されます。
こうした社会状況をふまえて、私達は「コロナ制圧タスクフォース」を立ち上げることにいたしました。当初は医師、研究者の少人数の仲間による議論でスタートしましたが、我が国を始め全世界で、毎日、多数の方々が亡くなられておられる現状を前にして、「医学」「科学」という観点から社会に貢献することはできないかと、多数の人々が集まり、その輪が広がっています。
ICUの最前線で診療に当たられている方々、大学病院で働いておられる医療スタッフ、地域医療の最前線を担う開業医の方々、免疫学者、感染症学者、あるいはまた、医学の専門家ではないけれどもこうした活動に共感をもっていただける一般の方々が、チームを作って新型コロナウイスル感染症をより理解し、合理的な予防や治療に資する、「客観的な」研究や情報の発信を目指しています。本タスクフォースのミッションは以下のとおりです。
1) できるだけ多数のCOVID-19に罹患した患者の検体(DNA, RNA, 血漿)および臨床情報を集積することにより、国際協調も含めた研究の推進に資すること
2) 臨床検体を用いた基礎的な研究を推進すること
3) ワクチン開発を推進すること
すでに検体の集積は始まっていて、2020年5月19日現在で、10施設で研究の倫理委員会の承認を得て検体集積が始まっており、40施設が倫理委員会の承認を申請しており、間もなく検体の集積が大規模に行われます。今後とも、できるだけ多くの医療機関の参画をお願いしてまいりたいと考えています。最初の具体的な研究目標は、COVID-19の重症化に関わる宿主側(患者側)の因子、とくに遺伝学的な因子を明らかにすることです。なお、研究成果と研究の進捗は定期的に本サイトで更新されます。
研究の背景と抗ウイルス免疫について
COVID-19は、人類に対する大きな脅威となっています。とくに欧米諸国では、COVID-19による死者はすでに数十万人に及び甚大な被害が生じています。一方、日本を始めとする東アジア諸国においても、COVID-19の蔓延は深刻な公衆衛生上・社会上の問題となっていますが、これに伴う死亡率は欧米諸国と比較して低く、国際的にも注目されています。その要因としては、高いマスク着用率と手指衛生遵守率、過去の類似ウイルス流行による潜在的獲得免疫の存在の可能性、BCG接種、特に日本においては国民皆保険制度を基盤とする医療システムと医療水準などが指摘されていますが、人種間での遺伝学的な相違が関与する可能性が大きいのではないかと推測されています。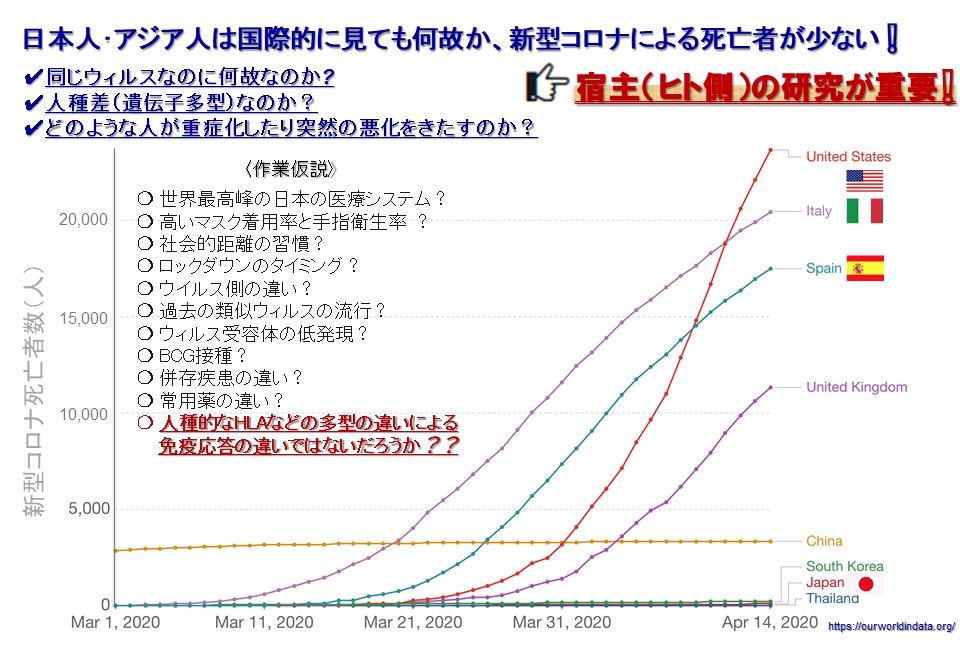
一般にヒトが未知のウイルスに感染すると、これを排除するためにさまざまな生体の仕組みが惹起されます。こうした仕組みは「免疫」と呼ばれますが、免疫は大きく分けて、「自然免疫」と「獲得免疫」とに分けられます。前者はさまざまな細菌やウイルス、毒素に対して生まれつき人間に備わっている仕組みで、感染が生じた場合に直ちに動員される仕組みです。一方、獲得免疫は、やや遅れて動員される免疫反応で、特定のウイルスに感染した細胞を特異的に認識する細胞障害性T細胞と呼ばれる細胞によってウイルスに感染した細胞が除去される
一方、B細胞と呼ばれる細胞によって、ウイルスを中和する特異的な抗体の産生が行われるようになります。後者の免疫は、一旦成立すると、これによって「獲得」され、次に同じウイルスに感染した場合には、速やかにそのウイルスを排除できるようになります。
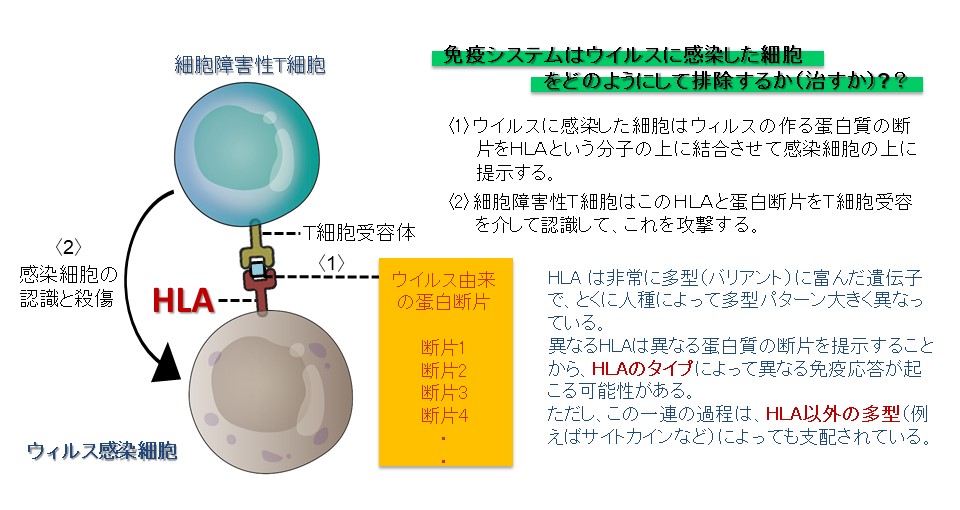
「多型」と呼ばれる個人間の遺伝子の塩基配列の違いにより、こうしたウイルスに対する免疫応答も異なっています。つまり、その多型の違いによって、同じウイルスに感染しても、異なった免疫反応を生じます。中でも、HLA(注3)と総称される一群の分子は、獲得免疫を誘導する、いわば司令塔のような役割を担っており、「エピトープ」と総称されるウイルスのタンパク質の一部をその上に特異的に結合します。このHLAに結合した「エピトープ」がT細胞受容体とよばれるT細胞によって認識されることが、細胞障害性T細胞や抗体を産生するB細胞の機能に代表される「獲得免疫」が機能する鍵となります。
このHLAには非常に多くの種類、(HLA A, B, C, DR, DQ, DPなど)の遺伝子が存在し、また、それぞれのHLAについても(例えばHLA A)についても、個人によって異なる多型が知られており、ウイルスに対する応答性の違いだけでなく、花粉症やその他の免疫が関わる多くの病気になりやすさの違いに関係していると考えられます。一方、自然免疫を含むこれらの免疫反応は、HLAの多型以外の個人のバリエーションによっても強く影響をうけることが知られており、従って、COVID-19の重症化にはHLAを含むさまざまな多型が重要な役割を担っていることが示唆されます。
それでは、「HLAを含めた多型がCOVID-19の重症化に関わっているのか?」、もし、そうだとしたら、「一体、どの遺伝子のどのような多型がそれに関与するのか?」という疑問が生じます。もし、そのような多型があれば、重症の患者と、軽症ないし無症状の患者で、その頻度が異なることが推察されます。
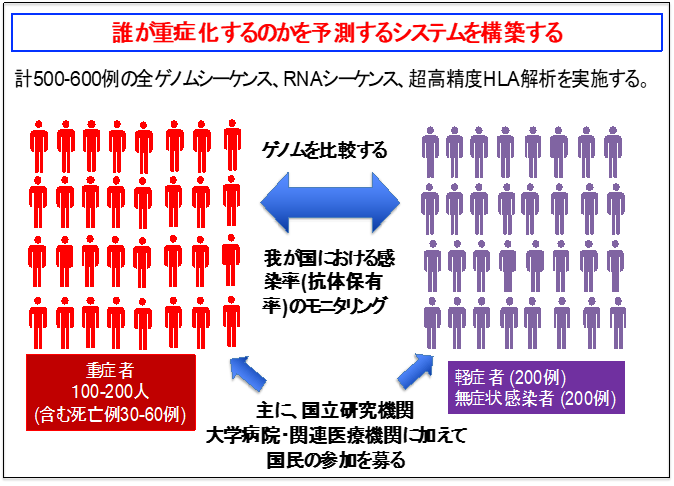
そこで、今回の私達の研究では、まず、COVID-19で重症化した患者と軽症ないし無症状で終わった患者のすべての遺伝子配列を決定して、両者で頻度に違いのある多型を見つけることを目的としています。COVID-19の重症化に関わる因子の一つとして「サイトカインストーム」という現象が注目されています。これは免疫細胞の機能やそれに反応した生体の反応を調節する「サイトカイン」(注4)と呼ばれるタンパク質が、正常の応答の範囲を大きく逸脱して、過剰に産生される結果、ウイルスに感染した細胞のみならず、正常の細胞・臓器まで障害されてしまう現象です。このような現象も、遺伝子多型によって影響を受けている可能性があります。
一方、新興ウイルス感染症の克服には有効なワクチンの開発が鍵となります。COVID-19の重症化に関与する日本人特有の遺伝子を特定できれば、COVID-19の重症化予測そして有効な治療薬の開発に役立つだけでなく、ワクチン開発の加速が期待されます。また、当研究グループは分子ニードル技術やオルガノイド(注5)技術などの独自の技術を有しており、SARS-CoV-2のワクチン開発にこれらの独自技術が相乗効果を生むことが期待されます。
研究の計画
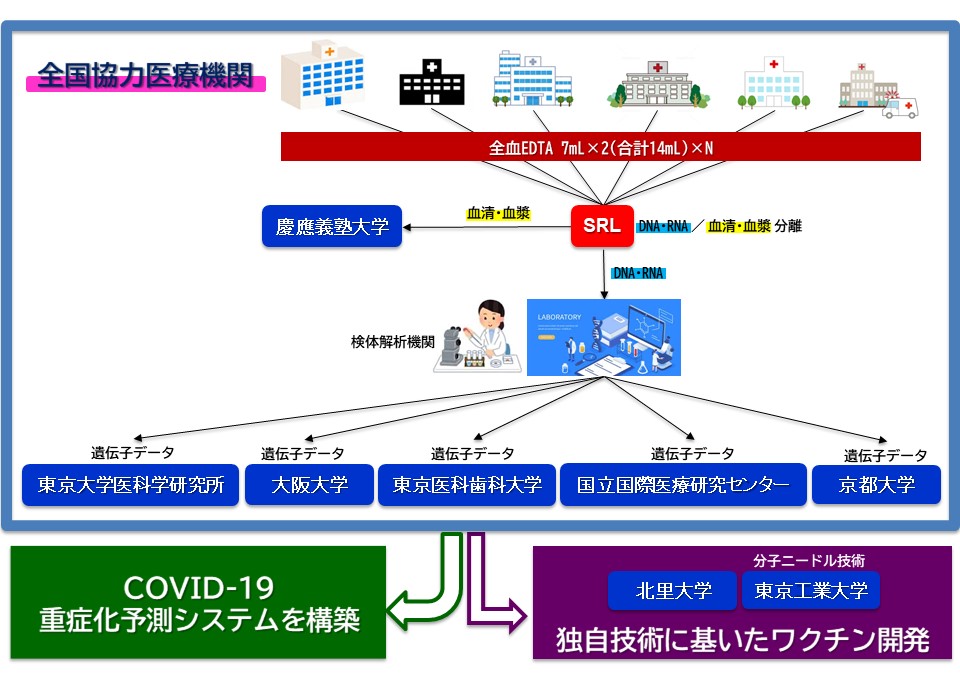
コロナ制圧タスクフォースの研究チームは、共同研究機関(5月19日現在40病院)から日本人COVID-19患者の血液検体を600人分集積する予定です。これらの検体を用いて、高解像度HLA解析(注6)、SNPアレイ解析(注7)、全ゲノムシーケンス解析(注8)T細胞レパトア解析などの包括的な解析を行い、重症化例および軽症ないし無症候感染例を比較することにより、日本人COVID-19患者の重症化に関わる遺伝子の同定を目指します。ワクチンのターゲットとなるエピトープを決定することは、ワクチン開発の上で非常に重要なステップですが、このエピトープを予測することは困難とされています。今回、コロナ制圧タスクフォースの研究チームは、日本人COVID-19患者の重症化に関わる遺伝子同定後に、次のステップとしてスパコンシミュレーションにより重症化に関わるSARS-CoV-2の抗原候補の同定を目指し、重症化の予防により適したワクチン開発を行います。
なお一連のゲノム解析については、すでに慶應義塾大学および大阪大学における倫理委員会で承認されており、協力医療機関の追加を募りつつ、承認された医療機関より逐次検体収集を開始しています。
また、コロナ制圧タスクフォースでは、COVID-19の重症感染者と軽症・無症候感染者の遺伝学的・免疫学的解析から得られる情報を基盤に、独自の分子ニードル技術に基づき、SARS-CoV-2に対する有効な粘膜ワクチン(注9)の開発を目指します。
分子ニードル技術とは、バクテリオファージの尾部先端にある長さ約10ナノメートルの蛋白質の針(分子ニードル)を利用した、蛋白質分子の運搬技術です。分子ニードルは、自発的に細胞膜を貫通して細胞内に侵入する性質があります。この分子ニードルに、ワクチンの成分となるウイルスの蛋白質や、ペプチド配列を融合させて、鼻腔や舌下など粘膜経由で接種すると、体内(細胞内に)にウイルス抗原を届けることができるため、効率良くウイルスに対する免疫応答を誘導できます。従来のワクチンは、皮下注射で接種するタイプが主流ですが、分子ニードル技術を利用したワクチンの接種は、鼻からの吸引、舌下への滴下、またはカプセルを飲むことで実施できますので、痛みも無く安全です。
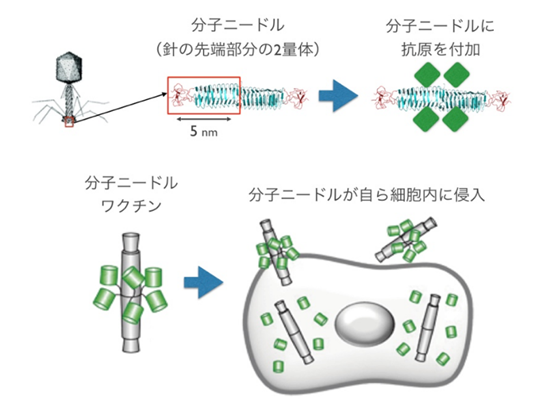
本研究では、COVID-19の重症化に関する遺伝子を探索しますが、COVID-19の免疫応答に関与する遺伝子も網羅的に調べます。その成果を利用し、COVID-19の原因ウイルスであるSARS-CoV-2の蛋白質配列のうち、効果的にCOVID-19の重症化を防ぎ、治癒や予防に結びつく部分を見つけ出すことが期待されています。私達は、このようにして発見されたSARS-CoV-2の蛋白質や、ペプチド配列を融合させた分子ニードルワクチンを開発していきます。
今後の展開
コロナ制圧タスクフォースでは、多くの共同研究施設を募集しております(https://www.covid19-taskforce.jp/)。本年、7月に一旦収集した検体のヒト遺伝子を解析し、9月を目処に研究成果を速やかにまとめる予定です。本解析によって、COVID-19の日本人における重症化関連遺伝子を明らかにすることにより、COVID-19診断時に重症化を予測し、医療行政の指標として活用することによって、COVID-19第2波、第3波での医療指針に反映させ、医療崩壊を防止することが期待されます。さらに、得られる免疫学的遺伝子の情報を基盤に、多くの日本人に適応するSARS-CoV-2ワクチンのデザインに利用できることが期待されます。
特記事項
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の創薬支援推進事業;新型コロナウイルス感染症(COVID-19)に対するワクチン開発における研究開発課題「新型コロナウイルス感染症の遺伝学的知見に基づいた分子ニードルCOVID-19粘膜免疫ワクチンの開発」(研究開発代表者:金井隆典)に採択され行われます。本研究は、AMED研究費と本研究プロジェクトにご賛同いただきました寄付者からの寄付金を基に実施されます。
タスクフォースメンバー
慶應義塾大学:教授 金井隆典、教授 福永興壱、教授 長谷川直樹、教授 佐藤俊朗、病院長 北川雄光東京医科歯科大学:M&Dデータ科学センター長 宮野悟、教授 小池竜司、教授 藍真澄、理事・副学長 木村彰方
大阪大学:教授 岡田随象、教授 熊ノ郷淳(大学院医学系研究科)
東京大学医科学研究所:教授 井元清哉
国立国際医療研究センター:プロジェクト長 徳永勝士
東京工業大学:教授 上野隆史(生命理工学院)
北里大学:教授 片山和彦、准教授 高野友美
京都大学:教授 小川誠司
用語解説
(注1)新型コロナウイルス(SARS-CoV-2):新型コロナウイルス感染症の原因となるウイルスのことを表します。2002年に流行したSARSコロナウイルスとウイルスが似ているため、SARS-CoV-2と命名されました。↑(注2)新型コロナウイルス感染症(COVID-19):coronavirus disease 2019(2019年に発生した新型コロナウイルス感染症)を略した言葉で、新型コロナウイルスによる病気のことを表します。2019年の終わり頃に、中国・武漢を中心に発生したのを皮切りに、その後、世界中に感染が拡大しました。新型コロナウイルスに感染すると、発熱や咳、息苦しさといった症状が出て、感染が肺に及び肺炎を発症すると呼吸困難に陥ります。↑
(注3)HLA:赤血球にはA型、B型、AB型、O型などの血液型があるように、白血球をはじめとする全身の細胞にも型があります。その型をヒト白血球抗原(HLA:Human Leukocyte Antigen)と呼んでいます。HLA型は、多様性が高く、個体間で大きな違いがありますが、抗原への免疫応答性に深く関わっています。このため、特定のHLA型ごとに特定の抗原への免疫応答性が異なることが知られています。↑
(注4)サイトカイン:細胞から分泌されるタンパク質の総称で、細胞と細胞の間の相互作用、特に免疫や炎症に大きな役割を果たします。SARS-CoV-2による感染症でも、免疫や炎症の異常を来たしていることが、多くの研究で報告されています。新型コロナウイルス(SARS-CoV-2):新型コロナウイルス感染症の原因となるウイルスのことを表します。2002年に流行したSARSコロナウイルスとウイルスが似ているため、SARS-CoV-2と命名されました。↑
(注5)オルガノイド:従来の細胞培養技術では、多くの細胞はシート状に培養されています。オルガノイドは細胞の増殖の足場となるジェルと増殖因子と呼ばれる栄養により、3次元構造として育てられた培養細胞を指します。1つの幹細胞から生体内の組織に似た構造を培養皿の中で作り出すことが可能であり、気道や肺などのさまざまな組織の正常細胞を無限に増やすことが可能です。↑
(注6)高解像度HLA解析:HLA遺伝子領域は多様性に富んでおり、人種間でも、個人の間でも、その配列が異なることが知られています。今回の研究では、次世代シークエンサーを用いて、詳細に解析することを目指します。↑
(注7)SNPアレイ解析:ヒトゲノムを構成する塩基配列が一つだけの塩基単位で変異した違いを、一塩基多型(SNP:Single Nucleotide Polymorphism)と呼びます。個人間の病気のかかりやすさの違いを生み出すことがあります。ゲノム全長のSNPを網羅的に解析する手法をSNPアレイと呼びます。↑
(注8)全ゲノムシーケンス解析:ゲノム情報をゲノム全長に渡って解析することです。主に高速で大量のゲノムの情報を読み取る「次世代シークエンサー」という解析装置で、多数の遺伝子を同時に調べます。↑
(注9)粘膜ワクチン:腸や鼻咽頭などの粘膜面をターゲットとして経口あるいは経鼻的な経粘膜に投与されるワクチンのことです。現状、多く普及されている注射型ワクチンと比較して、全身の免疫だけでなく、粘膜にも免疫を誘導することから、気道や消化器系といった粘膜面が侵入門戸となる病原体のワクチンとして期待されています。また、注射型ワクチンよりも非侵襲的であることから、実用的な面でもその普及が期待されています。
