乳腺腫瘍中における癌幹細胞を維持する機能の解明
乳腺腫瘍中における癌幹細胞を維持する機能の解明
~転写因子NF-κBはBasal-like乳癌細胞のJAG1発現を誘導し乳癌幹細胞のNOTCHシグナルを活性化することで乳癌幹細胞を維持する働きを持つ~
腫瘍中に含まれる癌細胞は細胞ごとに異なる腫瘍形成能などの性質を持ったheterogeneousな状態であることが古くから知られており、この腫瘍細胞のheterogeneityが治療への感受性の違いや、転移能の違いを生み出して癌治療を困難にしていると考えられている。最近、癌細胞も正常な組織を形成する細胞と同様に階層的な分化段階を持ち、未分化な癌幹細胞が分化を経て性質の異なる癌細胞を作り出しているという「癌幹細胞仮説」を支持する結果が相次いで報告されている。未分化な癌幹細胞は分化することで新たな癌細胞を作り出し腫瘍を形成することが出来るのに対して、分化した癌細胞は新たな腫瘍を作り出すことは出来ないことから、腫瘍中に含まれる癌幹細胞は転移や治療後の再発などの癌悪性化に重要な役割を持っていると考えられている。しかしながら、腫瘍中でこの癌幹細胞がどのように維持されているかという点については未解明な部分が多く残されている。
一方、NF-κBは炎症・免疫・細胞生存などに関わる転写因子である。正常な細胞ではNF-κBは抑制因子によるネガティブフィードバック機構によってその活性化が厳密に調節されている。しかしながら、これまでにBリンパ腫やATLなどの白血病細胞や乳癌、膵臓癌、脳腫瘍など様々ながん腫において活性化機構や抑制機構の異常によって恒常的にNF-κBが活性化し、癌細胞の生存や転移能、血管新生などを誘導して癌悪性化に寄与していることが報告されている。我々もこれまでに乳癌細胞株を用いた研究から、乳癌の中でも従来の治療標的分子であるホルモン受容体やERBB2を発現せず悪性度の高いトリプルネガティブ乳癌においてNF-κBが強く恒常的に活性化して癌細胞の細胞生存を誘導していることを明らかにしてきた。
今回我々は恒常的なNF-κB活性化が乳癌幹細胞に与える影響を検討するために、最初に乳癌細胞株を用いて恒常的なNF-κB活性化と乳癌幹細胞の割合の関係を調べた。その結果、興味深い事にホルモン受容体を発現するLuminal-like乳癌やERBB2過剰発現乳癌、トリプルネガティブ乳癌の一種であるClaudin-low乳癌ではNF-κB活性化と乳癌幹細胞の割合の間に相関が見られなかったのに対して、強い恒常的NF-κB活性化を示しトリプルネガティブ乳癌の大多数を占めるBasal-like乳癌ではNF-κB活性化と乳癌幹細胞の割合に正の相関関係があることが分かった。さらに、NF-κB活性化因子であるIKKβや抑制因子IκBαの過剰発現によってNF-κB活性化を調節すると、Basal-like乳癌においてのみ乳癌幹細胞の割合が変化することも分かった。次に、Basal-like乳癌におけるNF-κB活性化による乳癌幹細胞の割合の調節メカニズムを調べるために癌幹細胞と分化した非癌幹細胞とのNF-κB活性化を比較したところ、両者に大きな違いは見られなかった。一方で、NF-κB活性化を調節した乳癌細胞とNF-κB活性化を変化させていない乳癌細胞とを10:1の細胞数比で共培養すると、NF-κBを活性化させた乳癌細胞と共培養することでNF-κB活性化を変化させていない乳癌細胞中に含まれる乳癌幹細胞の割合が増加し、逆にNF-κBを抑制した乳癌細胞との共培養ではNF-κB活性化を変化させていない乳癌細胞中に含まれる乳癌幹細胞の割合が減少することを見出した。この結果から、周囲の乳癌細胞において恒常的NF-κB活性化が細胞外もしくは細胞膜で働く因子(リガンド)の発現を誘導し、この因子が乳癌幹細胞に働きかけてその割合を維持していることが示唆された。そこで次にNF-κB下流で発現誘導される因子に注目して解析を行った。Basal-like乳癌の乳癌幹細胞画分では前述のようにNF-κB活性化は乳癌細胞画分と違いがなかったが、乳癌形成への関与が報告されているNOTCHの標的遺伝子の発現が亢進していることが分かった。そこでNOTCHリガンドについてその発現量を調べたところ、Basal-like乳癌においてJAG1がNF-κB活性化によって発現調節されていることが分かった。興味深い事にNF-κB活性化によるJAG1発現亢進はLuminal-like乳癌やERBB2過剰発現乳癌、Claudin-low乳癌では見られず、JAG1は乳癌のサブタイプ特異的なNF-κB標的遺伝子あることが分かった。さらにRNAiによるJAG1発現抑制や、γ-secretase阻害剤によるNOTCHシグナル抑制によってNF-κB活性化による乳癌幹細胞の割合の増加が減弱することから、乳癌細胞におけるNF-κB依存的なJAG1発現が近傍の乳癌幹細胞のNOTCHシグナル活性化を介してBasal-like乳癌幹細胞の割合を増加させていることが示唆された(図1a)。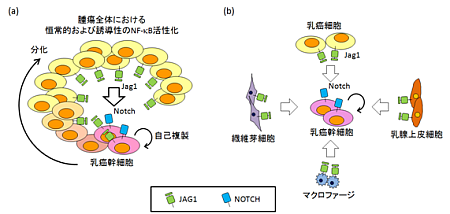 一方で、JAG1を強制的に過剰発現させるとBasal-like乳癌ではNOTCH活性化に伴って乳癌幹細胞の割合が増加するのに対して、Luminal-like乳癌やClaudin-low乳癌などではNOTCHは活性化するものの乳癌幹細胞の割合の増加が見られないことから、JAG1-NOTCHシグナルによる乳癌幹細胞維持機構はBasal-like乳癌に特異的なものであることが示唆された。さらに我々はこのサブタイプ特異的な乳癌幹細胞維持機構が実際の乳癌でも働いていることを示すため、公開されている乳癌臨床検体のマイクロアレイデータを解析した。その結果、トリプルネガティブ乳癌であるBasal-like乳癌とClaudin-low乳癌において既知のNF-κB標的遺伝子群の高発現が見られ、またBasal-like乳癌においてのみJAG1がNF-κB標的遺伝子群と同様の発現パターンを示すことが分かり、細胞株で見られたNF-κBの恒常的活性化とJAG1発現誘導に関するサブタイプ特異性が実際の乳癌検体にも存在することが示唆された。また乳癌幹細胞は転移に重要な役割を持つと考えられていることからJAG1発現量と転移率との関係を解析した。その結果、Basal-like乳癌においてのみJAG1高発現群で有意に転移率が高いことが分かり、臨床検体においてもBasal-like乳癌特異的にJAG1-NOTCHシグナルによって乳癌幹細胞が増加している可能性が示された。本研究ではこれらの腫瘍細胞による乳癌幹細胞維持機構の解析に加えて、正常乳腺上皮細胞や繊維芽細胞、マクロファージにおいても妊娠や炎症によってJAG1が発現誘導されることも明らかにしており、腫瘍中で正常細胞がBasal-like乳癌幹細胞のニッチとして働く可能性も示唆している(図1b)。
一方で、JAG1を強制的に過剰発現させるとBasal-like乳癌ではNOTCH活性化に伴って乳癌幹細胞の割合が増加するのに対して、Luminal-like乳癌やClaudin-low乳癌などではNOTCHは活性化するものの乳癌幹細胞の割合の増加が見られないことから、JAG1-NOTCHシグナルによる乳癌幹細胞維持機構はBasal-like乳癌に特異的なものであることが示唆された。さらに我々はこのサブタイプ特異的な乳癌幹細胞維持機構が実際の乳癌でも働いていることを示すため、公開されている乳癌臨床検体のマイクロアレイデータを解析した。その結果、トリプルネガティブ乳癌であるBasal-like乳癌とClaudin-low乳癌において既知のNF-κB標的遺伝子群の高発現が見られ、またBasal-like乳癌においてのみJAG1がNF-κB標的遺伝子群と同様の発現パターンを示すことが分かり、細胞株で見られたNF-κBの恒常的活性化とJAG1発現誘導に関するサブタイプ特異性が実際の乳癌検体にも存在することが示唆された。また乳癌幹細胞は転移に重要な役割を持つと考えられていることからJAG1発現量と転移率との関係を解析した。その結果、Basal-like乳癌においてのみJAG1高発現群で有意に転移率が高いことが分かり、臨床検体においてもBasal-like乳癌特異的にJAG1-NOTCHシグナルによって乳癌幹細胞が増加している可能性が示された。本研究ではこれらの腫瘍細胞による乳癌幹細胞維持機構の解析に加えて、正常乳腺上皮細胞や繊維芽細胞、マクロファージにおいても妊娠や炎症によってJAG1が発現誘導されることも明らかにしており、腫瘍中で正常細胞がBasal-like乳癌幹細胞のニッチとして働く可能性も示唆している(図1b)。
(a)腫瘍細胞間における乳癌幹細胞維持機構。腫瘍中には少数の癌幹細胞とそこから分化して大多数を占める非癌幹細胞が存在する。Basal-like乳癌では腫瘍全体の細胞で転写因子NF-κBが恒常的に活性化しJAG1の発現を誘導している。このJAG1が乳癌幹細胞のNOTCHシグナルの活性化を介して乳癌幹細胞の自己複製を誘導することが明らかとなり、腫瘍中では周囲の乳癌細胞が乳癌幹細胞のニッチとしてその維持を担っていることが示唆された。(b)腫瘍内微小環境における正常細胞による乳癌幹細胞維持機構。JAG1は乳腺上皮細胞や繊維芽細胞、マクロファージなどの正常細胞においても妊娠・炎症などの発癌との関連が既に報告されている時期に過剰発現することが示唆された。そのため乳癌細胞だけでなく、これら正常細胞もニッチとして乳癌幹細胞の維持に寄与する可能性が考えられる。
以上より、本研究で明らかとしたNF-κB‐JAG1‐NOTCHシグナルによる乳癌幹細胞維持機構は、「周囲の乳癌細胞(主に非癌幹細胞)におけるNF-κB活性化によるJAG1発現誘導」と「乳癌幹細胞におけるNOTCH活性化による乳癌幹細胞の自己複製」という2つの段階においてBasal-like乳癌に特異的な機構であり、これまで有効な治療標的分子が無かったBasal-like乳癌の新規治療法開発への応用が期待される。また従来の治療法では完全に除去することが難しかった乳癌幹細胞を標的とした新規乳癌治療法の開発にも役立つと考えられるため、現在、乳癌臨床検体などを用いて腫瘍中におけるこの機構の重要性を明らかにすべく検討を行っている。
