| 発表のポイント |
|---|
|
概要
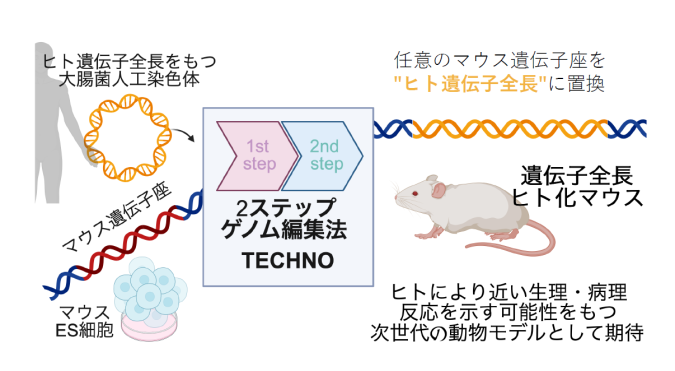
東京大学医科学研究所附属システム疾患モデル研究センター先進モデル動物作製コアの田口純平特任助教、菊池美緒技術専門職員、小沢学准教授らの研究グループは、任意のマウス遺伝子座(注1)をヒト遺伝子全長に置き換えた“遺伝子全長ヒト化マウス (注2)”を単純かつ効率的に作出可能な汎用ゲノム編集技術「TECHNO: Two-step ES Cell-based HumaNizatiOn」を開発しました。本手法で作製されたヒト化マウスは、ヒトで見られる臓器・細胞種特異的なmRNA・タンパク質発現パターンを模するとともに、疾患原因変異を導入することでヒト指定難病の特徴を再現できることが明らかになりました。本成果によって作出される遺伝子全長ヒト化マウスは、通常マウスと比較してよりヒトに近い生理・病理反応を示す可能性をもつ次世代の動物モデルとして、医薬品開発やヒト疾患の病因解明・治療法の探索など多様な医学・生命科学研究の進展に貢献することが期待されます。
本研究成果は2026年1月14日付で、米国科学雑誌「Nature Communications」オンライン版に公開されました。
発表内容
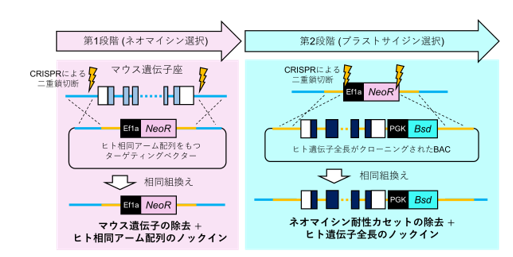
マウスは、遺伝子の99%がヒトでも保存されており、有用なモデル動物としてヒト医学・生命科学研究に多大な貢献をしてきました。しかし、マウスとヒトの遺伝子を構成する塩基配列 (注3)は完全に一致しているわけではなく、中でも遺伝子が発現する場所(臓器/細胞種)や時期などをコントロールする転写制御領域・非翻訳領域(注4)は種間で保存性が低いことから、マウスがヒトの正確なモデルとならない例も報告されています。そのため、よりヒトに近い遺伝子発現パターンを示す可能性がある「遺伝子全長ヒト化マウス」の作製が求められていましたが、数百kbp(注5)に及ぶ遺伝子全長を効率よく高精度に置換する汎用技術は存在しませんでした。本研究では、CRISPR-Cas9(注6)による2段階のゲノム編集と、高い相同組換え能をもつマウスES細胞(胚性幹細胞)(注7)を組み合わせることで、100kbpを超える大規模ゲノム領域を対象とした遺伝子全長ヒト化技術を開発しました。第1段階では、マウス遺伝子座を除去すると同時に、ヒト遺伝子領域両端に対応する相同配列を薬剤耐性カセット(注8)とともにノックインし、第2段階では、先に導入した相同配列を「足場」に、大腸菌人工染色体(BAC)(注9)に含まれるヒト遺伝子全長を異なる薬剤耐性カセットとともに導入しました(図1)。

(a): 4週齢のc-Kit遺伝子全長ヒト化マウス。相同染色体の一方(Hetero)あるいは両方(Homo)がヒト化されている。
(b): c-Kit遺伝子全長ヒト化ES細胞のゲノム解析。期待どおりの正確な組換えが確認されている。
(c): ヒトc-KIT特異的抗体を使用したc-Kit遺伝子全長ヒト化マウス諸臓器の免疫染色。ヒトと同様の臓器/細胞種特異的なヒトc-KITタンパク発現パターンが観察された。(陽性: 小脳・肺・精巣、陰性: 心臓)
次に、本技術の汎用性を評価するため、200kbp超の巨大遺伝子クラスターであるAPOBEC3遺伝子座の組換えを試みたところ、同じく10-15%の高い効率で全長ヒト化が誘導されました。重要なことに、ヒト化マウス肺でのAPOBEC3ファミリー遺伝子7種の発現バランスはヒト肺のパターンと高い相関を示すことも明らかとなりました(図3)。
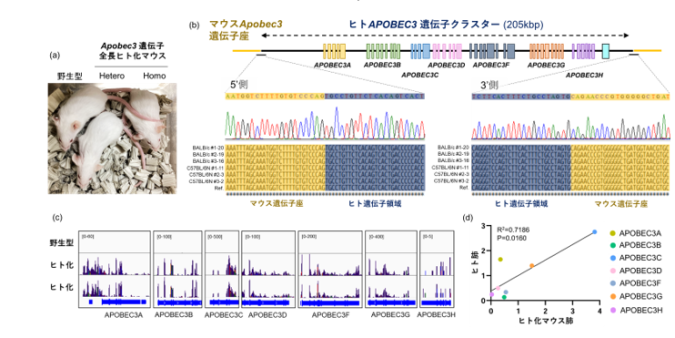
(a): 4週齢のApobec3遺伝子全長ヒト化マウス
(b): Apobec3遺伝子全長ヒト化ES細胞のゲノム解析。期待どおりの正確な組換えが確認されている。
(c): Apobec3遺伝子全長ヒト化マウス肺のRNA-sequence解析。ヒトAPOBEC3遺伝子7種全てのmRNA発現が確認された。
(d): ヒト肺とヒト化マウス肺間での各APOBEC3遺伝子の発現バランスの比較。ヒト化マウス肺における各ヒトAPOBEC3遺伝子の発現バランスはヒト肺データと有意な相関を示した。
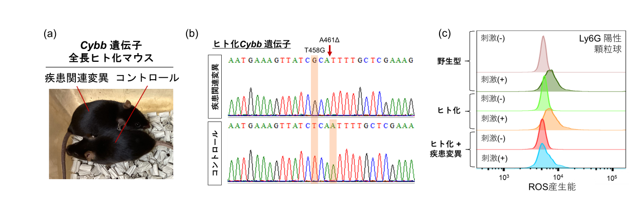
(a): ヒト化Cybb遺伝子に疾患関連変異が導入された8週齢のマウス
(b): ヒト化Cybb遺伝子に疾患関連変異を導入したES細胞のシークエンス解析
(c): 疾患関連変異をもつCybb遺伝子全長ヒト化マウス顆粒球におけるROS産生能。野生型やヒト化(コントロール)マウスと比較してROS産生能が低下しており、ヒト慢性肉芽腫症の症状を再現している。
TECHNOの開発により、今まで技術的に困難であった遺伝子全長ヒト化の効率が飛躍的に向上しました。ヒト遺伝子の約93%は200kbp以下のサイズであることから、TECHNOは大多数のヒト遺伝子に応用可能な汎用技術であると言えます。本技術によって得られた遺伝子全長ヒト化マウスは、よりヒトに近い生理・病理反応を示す可能性をもつ次世代の動物モデルとして、医薬品開発やヒト疾患の病因解明・治療法の探索など多様な医学・生命科学研究の進展に貢献することが期待されます。
本研究は東京大学医科学研究所における動物実験委員会の承認のもと、東京大学が定めた動物実験の取り扱いに関する指針(承認番号: A2024IMS013-01)に則り実施されました。
発表者・研究者等情報
東京大学医科学研究所 附属システム疾患モデル研究センター 先進モデル動物作製コア
小沢 学 准教授
田口 純平 特任助教
菊池 美緒 技術専門職員
小沢 学 准教授
田口 純平 特任助教
菊池 美緒 技術専門職員
論文情報
雑誌名: Nature Communications題 名: A scalable two-step genome editing strategy for generating full-length gene-humanized mice at diverse genomic loci
著者名: Jumpei Taguchi, Mio Kikuchi, Hyojung Jeon, Ryo Shimizu, Hideto Mori, Masahito Ikawa, Yasuhiro Yamada, Kei Sato, Terumasa Ikeda, Satoshi Yamazaki, Manabu Ozawa*
(*Corresponding author)
DOI: 10.1038/s41467-025-67900-4
URL: https://www.nature.com/articles/s41467-025-67900-4
研究助成
本研究成果は、東京大学医科学研究所、熊本大学、大阪大学、東京大学が共同で実施し、科研費「基盤研究(B) (23K27084)」、「若手研究 (25K18393)」、「基盤研究(S) (21H05033)」、公益財団法人稲盛財団「2024年度稲盛研究助成」の支援により実施されました。
用語解説
(注1)遺伝子座ゲノム上で特定の遺伝子が存在する染色体上の位置(領域)。タンパク質をコードする領域だけではなく、非コード領域やその遺伝子の発現を制御する配列を含む領域のこと。
(注2) 遺伝子全長ヒト化マウス
特定のマウス遺伝子座を、対応するヒトの遺伝子座に置き換えたマウス。タンパク質に翻訳されるコーディング領域だけでなく、アミノ酸情報を持たず成熟mRNAに残らないイントロンや、遺伝子の発現制御を担うプロモーターなどのDNA配列を含めた遺伝子全長をヒト化するため、生体内においてよりヒトに近い遺伝子発現パターンを示す可能性をもつ動物モデルとして期待されている。
(注3) 塩基配列
DNAやRNAといった核酸を構成する塩基の並び順。DNAはアデニン(A)、チミン(T)、グアニン(G)、シトシン(C)の4種類の塩基が連なり二重らせん構造を形成することで、遺伝子の機能や制御、タンパク質の設計図としてはたらいている。
(注4) 非翻訳領域
RNAのうち、翻訳されてタンパク質にならない配列。翻訳開始点の上流(5'untranslated region、5'UTR)および終止コドンの下流3'UTRなどが含まれる。mRNAの転写や安定性、翻訳効率の制御に関わる。
(注5) kbp
kilo-base-pair (1000塩基対)。2重らせん構造をとるDNAの長さを表す単位。
(注6) CRISPR-Cas9
細菌の免疫システムを応用して開発されたゲノム編集技術のひとつ。ゲノム上の特定のDNA配列を切断・改変できることから、遺伝子改変動物の作製などに広く用いられている。(本研究では、DNAヌクレアーゼであるCas9タンパク質とgRNAの複合体[Cas9-RNP: Cas9リボ核タンパク質]を電気穿孔法で細胞に導入することで、ゲノム編集を誘導している。参考文献: Ozawa M and Taguchi J et al. Sci Rep. 2022)
(注7) ES細胞 (胚性幹細胞)
受精卵から発生が進んだ胚盤胞の内部細胞塊から樹立される多能性幹細胞。体を構成するあらゆる細胞に分化する能力を持っており、遺伝子を改変したES細胞を初期胚に注入することで、組換え細胞が全身に寄与した遺伝子改変マウス(キメラマウス)を作製することができる。
(注8) 薬剤耐性カセット
抗生物質に対する耐性遺伝子を含むDNA配列。カセットが導入された細胞は薬剤存在下でも生存できるようになるため、遺伝子組換えを起こした細胞だけを選抜することが可能になる。
(注9) 大腸菌人工染色体(BAC: bacterial artificial chromosome)
大腸菌内で巨大なDNA断片(約200-300 kbp)を安定的に維持できるベクター。断片化されたヒトゲノムもクローニングされ、ライブラリー(RP11)としてリソース化されている。本研究では、特定のヒト遺伝子全長が組み込まれたBACをドナー配列とした。
(注10) 慢性肉芽腫症
好中球などの食細胞が持つ酵素の異常により、細菌や真菌に対する防御能が低下し、重い感染症や肉芽腫形成を繰り返す先天性免疫不全症。「原発性免疫不全症候群(難病指定65)」に含まれる指定難病である。
問合せ先
<研究内容について>東京大学医科学研究所 附属システム疾患モデル研究センター 先進モデル動物作製コア
准教授 小沢 学 (おざわ まなぶ)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/experimentalmedicine/page_00128.html
<機関窓口>
東京大学医科学研究所 プロジェクトコーディネーター室(広報)
https://www.ims.u-tokyo.ac.jp/
※2026/1/29 修正版に変更
変更箇所/タイトル、「発表のポイント」内の画像、本文の一部