| 発表のポイント |
|---|
|
発表内容
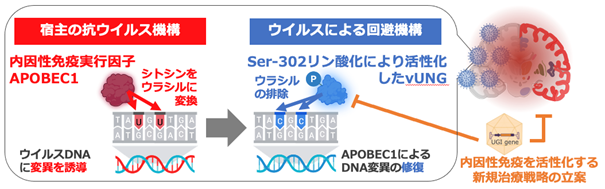
東京大学医科学研究所 感染・免疫部門 ウイルス病態制御分野の川口寧教授、加藤哲久准教授、ならびに播磨勇人大学院生(研究当時)(現:東京農工大学農学研究院 動物生命科学部門 獣医公衆衛生学研究室 助教)らの研究グループは、単純ヘルペスウイルス1型(HSV-1)(注1)がコードするウラシルDNAグリコシラーゼ(vUNG)(注2)が、中枢神経系において宿主の内因性免疫実行因子であるアポベック1(APOBEC1)(注3)の機能を打ち消すことによって、ヘルペス脳炎の発症を促進していることを明らかにしました。さらに、この知見を基に、vUNGを標的とするウイルスベクターによって宿主の内因性免疫を復活させ、致死的な脳炎の抑制につながる新たな治療戦略の可能性を提案しました。〈研究の背景〉
ヘルペスウイルスは、4億年以上の共進化の中で、宿主と高度な共生関係を築いてきました。しかし、HSV-1によるヘルペス脳炎は、例外的に致死的な疾患であり、これは中枢神経系においてHSV-1が宿主の免疫応答を巧妙に回避していることを示唆しています。したがって、脳内での宿主の免疫応答とHSV-1による回避機構との相互作用を明らかにすることは、ヘルペス脳炎の病態解明および新たな治療法の開発において極めて重要です。
〈研究の内容〉
まず、リン酸化プロテオーム解析(注4)により、vUNG のSer-302がリン酸化されることを明らかとしました。このリン酸化部位をアラニンに置換したvUNG変異ウイルス(vUNG-S302A)を作出したところ、vUNGの酵素活性が感染細胞内でほぼ消失し、マウス脳内でのウイルス産生量およびマウス致死率が有意に低下しました(図1)。この結果は、vUNGのSer-302リン酸化が酵素活性およびヘルペス脳炎の発症に重要であることを示しています。
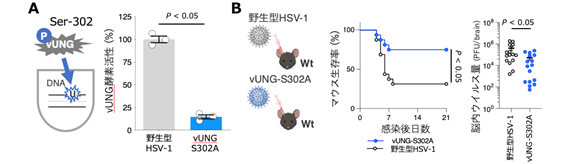
(A) リン酸化プロテオーム解析で同定したvUNG Ser-302のリン酸化を部位特異的変異により阻害した
組換えウイルス(vUNG-S302Aウイルス)では、vUNG酵素活性が有意に低下する。
(B) vUNG-S302A変異により、HSVを脳内に感染させたマウスの致死性(左図)および脳内における子孫ウイルス産生量(右図)が有意に低下する。
さらに、HSV-1感染によりマウス脳内でAPOBEC1の発現が誘導されたことから、APOBEC1はウイルスゲノム内のシトシンをウラシルへ変換し、変異導入を行っている可能性が示唆されました。実際、vUNG-S302A変異ウイルスに感染した野生型マウスでは、ウイルスゲノム上にAPOBEC1依存のDNA変異が検出されました(図2A)。一方、APOBEC1欠損マウスや、リン酸化vUNGを有するウイルスの感染ではDNA変異は検出されず、vUNG-S302A変異ウイルスによる致死率の低下も認められませんでした(図2B)。これにより、vUNGは中枢神経系においてAPOBEC1の抗ウイルス活性を抑制し、効率的なヘルペス脳炎の発症に寄与していることが明らかとなりました。
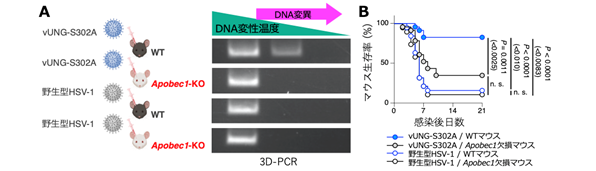
(A) vUNG-S302Aウイルスが感染したAPOBEC1をもつ野生型マウスでのみ、DNA変異が検出された。このDNA変異は、APOBEC1欠損やリン酸化vUNGの存在下では検出されなかった。
(B) vUNG-S302A変異によるマウス致死性の低下は、APOBEC1欠損により消失した。
最後に、バクテリオファージ由来の小分子UGIがvUNGを阻害することが知られていたことから、UGIを発現するアデノ随伴ウイルスベクター(注5)(AAV-UGI)を作出しました(図3AおよびB)。このAAV-UGIを野生型マウスに投与しHSV-1を感染させたところ、マウスの致死率が有意に低下しました。一方、APOBEC1欠損マウスでは、AAV-UGIによる致死抑制効果は認められませんでした(図3C)。この結果は、vUNGを阻害することで、APOBEC1による内因性免疫が回復し、ヘルペス脳炎が抑制されうることを示しています。
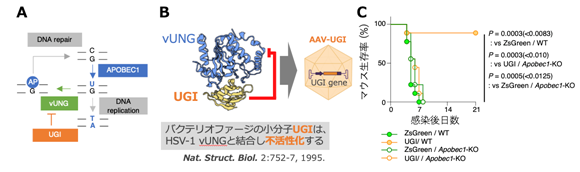
(A) APOBEC1によるC to U変異はvUNGに除去された後、DNA修復されるが、UGIはこの経路を阻害する。
(B) vUNG阻害活性を有するUGIを発現するアデノ随伴ウイルスベクター(AAV-UGI)を作出した。
(C) AAV-UGI投与により、野生型マウスではヘルペス脳炎による致死性が有意に阻害された。一方、APOBEC1欠損マウスでは、AAV-UGIによるヘルペス脳炎抑制効果が消失した。
〈今後の展望〉
本研究成果は、ウイルスが進化の過程で獲得した免疫回避機構(vUNG)を標的にすることで、宿主に”もともと備わったウイルス抵抗力”を復活させ、ウイルス疾患の治療につなげられる可能性を示しました。特に、ウイルス因子vUNGと宿主因子APOBEC1間の相互作用をin vivoで解析し、ウイルス・宿主ゲノム両者の改変を通じてその機能を明らかにした点は、学術的に極めて重要な成果です。さらに、本研究により「内因性免疫」が新たなウイルス治療標的になり得ることが示されたことは、次世代抗ウイルス戦略の創出に向けた重要な道筋を提供すると期待されます。
本研究成果は2025年6月3日18時(英国夏時間:3日午前10時)、英国の科学雑誌「Nature Microbiology」のオンライン版で公開されました。
発表者・研究者等情報
東京大学医科学研究所 感染・免疫部門 ウイルス病態制御分野
川口 寧 教授
加藤 哲久 准教授
播磨 勇人 研究当時:同大学大学院医学系研究科 病因・病理学専攻 博士課程
現:東京農工大学農学研究院 動物生命科学部門 獣医公衆衛生学研究室 助教
川口 寧 教授
加藤 哲久 准教授
播磨 勇人 研究当時:同大学大学院医学系研究科 病因・病理学専攻 博士課程
現:東京農工大学農学研究院 動物生命科学部門 獣医公衆衛生学研究室 助教
論文情報
雑誌名:Nature Microbiology題 名:Herpes simplex virus-1 evades APOBEC1-mediated immunity via its uracil DNA glycosylase in mice
著者名:Akihisa Kato1#, Hayato Harima2#, Yuji Tsunekawa3, Manabu Igarashi4, Kouichi Kitamura5, Kousho Wakae5, Tomoaki Nishiyama6, Satoru Morimoto7, Toru Suzuki8, Hiroko Kozuka-Hata9, Masaaki Oyama9, Daisuke Motooka10, Mizuki Watanabe11, Kousuke Takeshima1, Yuhei Maruzuru1, Naoto Koyanagi1, Hideyuki Okano7, Toshifumi Inada8, Takashi Okada3, Masamichi Muramatsu12, and Yasushi Kawaguchi1*
(#共同第一著者, *責任著者)
1: 東京大学医科学研究所 感染・免疫部門 ウイルス病態制御分野
2: 研究当時:東京大学大学院医学系研究科 病因・病理学専攻 博士課程
現:東京農工大学農学研究院 動物生命科学部門 獣医公衆衛生学研究室
3: 東京大学医科学研究所 附属遺伝子・細胞治療センター 分子遺伝医学分野
4: 北海道大学人獣共通感染症国際共同研究所 国際疫学部門
5: 国立健康危機管理研究機構 国立感染症研究所 ウイルス第二部
6: 富山大学 学術研究部理学系
7: 慶應義塾大学 再生医療リサーチセンター
8: 東京大学医科学研究所 基礎医科学部門 RNA制御学分野
9: 東京大学医科学研究所 附属疾患プロテオミクスラボラトリー
10: 大阪大学 微生物病研究所 バイオインフォマティクスセンター ゲノム解析室
11: 研究当時:東京大学大学院医学系研究科 病因・病理学専攻 博士課程
12: 神戸医療産業都市推進機構 先端医療研究センター 感染症制御研究部
DOI: 10.1038/s41564-025-02026-3
URL: https://www.nature.com/articles/s41564-025-02026-3
研究助成
本研究成果は、東京大学医科学研究所、北海道大学、富山大学、慶應義塾大学、国立感染症研究所、神戸医療産業都市推進機構が共同で実施し、科研費「基盤研究(S)(20H05692)」、日本医療研究開発機構(AMED)「新興・再興感染症研究基盤創生事業 中国拠点を基軸とした新興・再興および輸入感染症制御に向けた基盤研究(JP20wm0125002)」ならびに、「AMED SCARDAワクチン開発のための世界トップレベル研究開発拠点の形成事業 ワクチン開発のための世界トップレベル研究開発拠点群 東京フラッグシップキャンパス(東京大学新世代感染症センター)(JP223fa627001)」、東京大学医科学研究所国際共同利用・共同研究拠点事業、科学技術振興機構(JST) 戦略的創造研究推進事業さきがけ(JPMJPR22R5)などの研究助成の支援により実施されました。
用語解説
(注1) 単純ヘルペスウイルス1型 (HSV-1)ヒトに広く感染し、口唇ヘルペス、脳炎、皮膚疾患、眼疾患、新生児ヘルペス等、多様な疾患を引き起こす。HSV感染症には、複数の抗ウイルス剤が開発されているが、ヘルペス脳炎に対する効果は限定的で、アンメットメディカルニーズ(未充足な医療ニーズ)が高い。
(注2) HSV-1 がコードするウラシルDNAグリコシラーゼ (vUNG)
DNA中のウラシルを除去する修復活性をもつ。これまでは、偶発的な化学反応や複製時のポリメラーゼのエラーによりHSV-1ゲノムに発生したウラシルの除去を開始するウイルス酵素と考えられてきたが、HSV-1増殖における詳細な役割は不明であった。
(注3) アポベック1(APOBEC1)
DNA/RNA編集酵素として知られるAPOBECファミリーの一員で、肝臓などでアポリポタンパク質B前駆体mRNA中のシトシンをウラシルに置換する。また、人工的な過剰発現時にはウイルスゲノムのシトシンをウラシルに変換して抗ウイルス効果を示すことは知れられていたが、生体内での実際の抗ウイルス作用は不明であった。
(注4) リン酸化プロテオーム解析
細胞や組織から抽出した全タンパク質(プロテオーム)を対象に、質量分析法などを用いて網羅的にリン酸化部位を同定・定量する手法。リン酸化修飾の変化を系統的に捉えることで、シグナル伝達経路や酵素活性制御のメカニズム解明に役立つ。今回の解析では、ウイルス因子vUNGのSer-302リン酸化を発見するのに用いた。
(注5) アデノ随伴ウイルスベクター
非エンベロープ型パルボウイルス科 Dependoparvovirus 属に属するアデノ随伴ウイルス(AAV)を基盤とした遺伝子導入用ベクター。搭載可能な外来遺伝子は約4.7 kbと小さいものの、長期かつ安定した発現と比較的低い免疫原性を示す。国内外で遺伝子治療用製剤として精力的に研究されている。
問合せ先
〈研究に関する問合せ〉東京大学医科学研究所 感染・免疫部門 ウイルス病態制御分野
教授 川口 寧(かわぐち やすし)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/microbiologyimmunology/section03.html
〈報道に関する問合せ〉
国立大学法人東京大学医科学研究所 プロジェクトコーディネーター室(広報)
https://www.ims.u-tokyo.ac.jp/