| ポイント |
|---|
|
要旨
東海国立大学機構 名古屋大学大学院医学系研究科 統合生理学分野の大屋愛実 助教、中村佳子 講師、中村和弘 教授の研究グループは、大阪大学医学部附属動物実験施設の宮坂佳樹 助教、東京大学医科学研究所の真下知士 教授、名古屋大学環境医学研究所の田中都 講師、菅波孝祥 教授との共同研究により、加齢性肥満(中年太り)の原因となる脳の仕組みを世界に先駆けてラットで発見しました。加齢に伴い太りやすくなりますが、そのメカニズムは不明でした。同研究グループは、代謝や摂食を調節する脳の視床下部のニューロン(神経細胞)に着目し、抗肥満機能を持つメラノコルチン4型受容体(MC4R)*1の細胞内局在が、ラットの加齢に伴ってどのように変わるかを調べました。MC4Rを可視化できる世界初の信頼性の高い抗体を作製して調べたところ、MC4Rが視床下部ニューロンの一次繊毛*2というアンテナ構造に局在し、その一次繊毛が加齢に伴い退縮することを発見しました。MC4R局在一次繊毛の退縮は過栄養状態で促進され、摂餌量を制限すると抑制されました。
遺伝子技術を使って、若いラットのMC4R局在一次繊毛を強制的に退縮させると、摂餌量が増えるとともに代謝量が低下し、肥満になりました。また、肥満患者で起こるレプチン抵抗性*3を示しました。逆に、加齢に伴うMC4R局在一次繊毛の退縮を人為的に抑制すると体重増加が抑制されました。
これらの結果から同研究グループは、加齢に伴って視床下部ニューロンのMC4R局在一次繊毛が退縮することによるMC4Rの減少が加齢性肥満の原因であることを突き止めました。この研究成果は肥満の根本的な原因に迫るものであり、肥満に起因する糖尿病などの様々な生活習慣病の未病段階での予防法や画期的な治療法の開発につながることが期待されます。
本研究成果は、2024年3月6日付(日本時間3月7日午前1時)米国科学誌『Cell Metabolism』に掲載されました。
1.背景
肥満は糖尿病や高血圧などの様々な生活習慣病につながることから大きな健康問題となっています。特に、欧米型の高カロリーの食事が普及し、飽食が進む現代では、加齢に伴い太りやすくなる加齢性肥満(いわゆる中年太り)の発症メカニズムの解明は喫緊の課題です。これまでの研究から、加齢性肥満の原因として全身の代謝の低下が挙げられていますが、加齢に伴って代謝が低下する原因やメカニズムはわかっていませんでした。本研究グループは、代謝や摂食を調節する脳の視床下部に存在し、抗肥満機能を持つメラノコルチン4型受容体(MC4R)に着目しました。体内に脂肪が蓄積すると白色脂肪細胞からレプチンというホルモンが分泌され、視床下部に作用します(図1、①)。視床下部のニューロン(神経細胞)に存在するMC4Rは、レプチンの作用によって視床下部内で分泌されるメラノコルチン(飽食シグナル分子)を受容し(図1、②)、そのニューロンの伝達活動を活性化することによって神経回路を作動させ、代謝量や熱産生(脂肪燃焼)量を増やすとともに食べる量を減らすことで抗肥満作用を示します(図1、③)。
MC4Rを欠損したマウスは著しい肥満を呈することから、MC4Rは抗肥満メカニズムにおいて重要な役割を担っていることがわかります。本研究グループは、世界でこれまでになく信頼性の高い、MC4R蛋白質を可視化できる抗体を作製し、ラットの視床下部においてMC4Rの局在が加齢に伴ってどのように変わるかを解析しました。
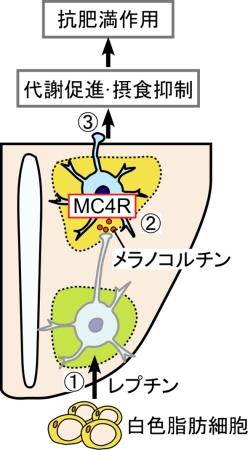
白色脂肪細胞からレプチンが分泌されると視床下部に作用して(①)、飽食シグナル分子であるメラノコルチンの分泌を誘導する。MC4Rはメラノコルチンを受容し(②)、自らが発現するニューロンの活動を活性化することによって神経回路を作動させ、代謝を促進するとともに摂食を抑制し、抗肥満作用を示す(③)。
2.研究成果
本研究グループはまず、作製したMC4R抗体を使ってMC4R蛋白質がラットの脳のどこにあるかを調べました。その結果、MC4Rは視床下部のみに存在し、その中でも視床下部室傍核*4および視床下部背内側部*5のニューロンの一次繊毛というアンテナ状の構造体に局在していることがわかりました(図2)。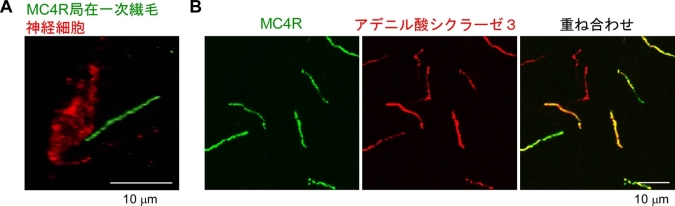
(A)視床下部の神経細胞(赤)から突出したMC4R局在一次繊毛(緑)。(B)視床下部のMC4Rを緑色に、アデニル酸シクラーゼ3を赤色に標識した。アデニル酸シクラーゼ3は一次繊毛に局在することが知られており、一次繊毛のマーカーとして用いた。MC4Rが一次繊毛上に局在することがわかった(重なると黄色)。
MC4Rの局在が加齢に伴ってどのように変化するかを調べるために、様々な週齢のラットの脳を観察したところ、離乳する3週齢以降、加齢に伴ってMC4R局在一次繊毛が徐々に退縮する(短くなる)ことがわかりました(図3、通常食)。一方、MC4Rを持たない一次繊毛は退縮しませんでした。次に、様々な栄養条件下で飼育したラットで解析を行ったところ、高脂肪食で飼育したラットでは加齢に伴う退縮のスピードが速くなっていました。反対に、摂餌量を制限したラットでは加齢に伴う退縮が抑えられていました(図3)。さらに、加齢によって一旦消失したMC4R局在一次繊毛であっても、摂餌量を制限することによって再生することもわかりました。
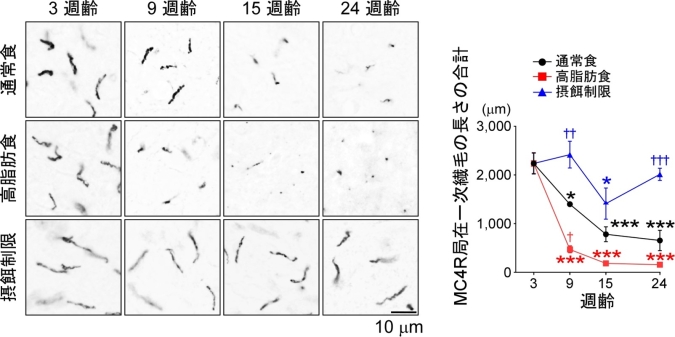
視床下部ニューロンのMC4R局在一次繊毛は週齢を経るにつれて短くなった(通常食)。高脂肪食を与えたラットは通常食を与えたラットより速く退縮した。摂餌量を通常の60%に制限したラットでは加齢に伴う退縮が抑制された。
そこで、遺伝子改変ラット(MC4R-Cre ノックインラット*6)とアデノ随伴ウイルス*7を使って、若いラットにおいてMC4R局在一次繊毛だけを強制的に退縮させたところ、飽食シグナル分子であるメラノコルチンへの感度が低下し、代謝量と熱産生(脂肪燃焼)量が減る一方で食べる餌の量は増え、結果として体重と体脂肪率の増加量が対照ラットに比べて著しく上昇しました(図4)。反対に、同様の遺伝子技術を使って、MC4R局在一次繊毛の加齢による退縮を抑制すると体重増加が抑制されました。
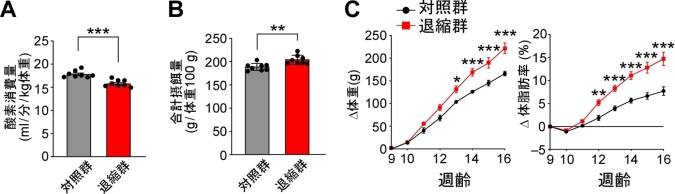
遺伝子技術を用いて視床下部のMC4R局在一次繊毛を退縮させた群(退縮群)は対照群よりも酸素消費量(代謝量)が少なく(A)、摂餌量が多くなった(B)。その結果、退縮群は対照群に比べ、体重と体脂肪率の増加量が著しく上昇した(C)。
次に、MC4R局在一次繊毛の退縮メカニズムの解明を試みました。まず、レプチンを介する飽食シグナルが減弱したZucker fatty変異ラット*8を解析しました。このラットは著しい肥満を呈することから、当初、MC4R局在一次繊毛の退縮が進行しているものと予想されましたが、意外なことに、その退縮が抑制されていました。このことから、レプチンの作用によって分泌されるメラノコルチン自体がMC4R局在一次繊毛の退縮を促進するのではないかと考えました。そこで、通常の野生型ラットにおいて、長期間にわたるレプチンの投与や、あるいは遺伝子技術を使って視床下部のニューロンにメラノコルチンが作用し続けているような状態を作りだすと、加齢に伴うMC4R局在一次繊毛の退縮が加速することがわかりました。これらの結果から、レプチンが持続的に作用するような状況では、メラノコルチンがMC4Rへ慢性的に作用するようになり、MC4R局在一次繊毛の退縮が促進されることが示されました(図5)。
さらに興味深いことに、白色脂肪細胞から分泌されるレプチンは食べる量を減らして抗肥満作用を発揮しますが、MC4R局在一次繊毛を退縮させたラットは、レプチンを投与しても食べる量が減らないというレプチン抵抗性を示しました。レプチンが効かず抗肥満作用が得られないレプチン抵抗性は肥満患者でもよく見られます。それが起こる原因は長らく不明であり、肥満治療の大きな問題でしたが、本研究により、肥満患者の体内に蓄積した白色脂肪細胞から多量に分泌されるレプチンが引き金で起こるメラノコルチンの慢性的な作用によってMC4R局在一次繊毛が退縮してしまうことが原因である可能性が示されました。
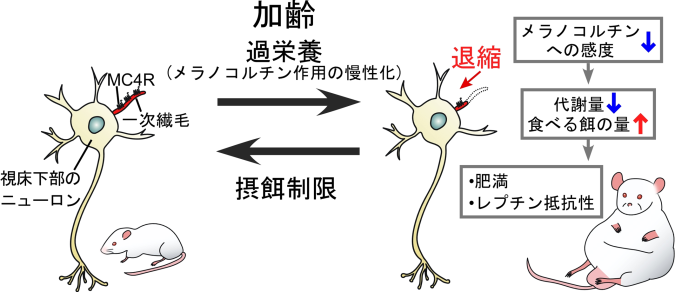
加齢によって視床下部ニューロンのMC4R局在一次繊毛が退縮する。加えて、高脂肪食摂取などの過栄養によって慢性化するメラノコルチン作用は退縮を促進させる。MC4R局在一次繊毛が退縮すると、飽食シグナル分子であるメラノコルチンへの感度が低下し、代謝量が低下する一方で摂餌量が増え、肥満やレプチン抵抗性の発現につながる。摂餌制限はMC4R局在一次繊毛の退縮を抑制する。
3.今後の展開
本研究グループは、MC4Rが代謝や摂食を調節する視床下部のニューロンの一次繊毛に局在し、加齢に伴ってその一次繊毛が退縮することを見出しました。そして、一次繊毛の退縮によりMC4Rが減少してメラノコルチンに対する感度が低下するため、代謝量が減るとともに摂餌量が増え、加齢性肥満に至るというメカニズムを解明しました(図5)。つまり、MC4R局在一次繊毛の長さが「痩せやすさ」を決定しており、それが加齢や過栄養(飽食)によって短くなることが肥満につながるということを示しています。メラノコルチンの短期的な作用は抗肥満ですが、本研究の実験結果は、過栄養(飽食)状態が続くとメラノコルチンが一次繊毛上のMC4Rに慢性的に作用することにより、視床下部ニューロンのMC4R局在一次繊毛の退縮が促進され、メラノコルチンが効かなくなるという「肥満への負のスパイラル」に陥ることを示しています。肥満が進行すると血液中のレプチン濃度が上昇し(高レプチン血症)、そしてレプチン抵抗性の状態に陥ります。これは、高濃度のレプチンがメラノコルチンの作用を慢性化させ、視床下部ニューロンのMC4R局在一次繊毛を退縮させるため、抗肥満作用が失われてしまうことが原因である可能性が本研究の実験結果から考えられます。
ヒトにおいては、一次繊毛の欠損や機能異常によって発症する遺伝病であるバーデット・ビードル症候群(Bardet-Biedl syndrome)が著しい肥満を呈することが知られており、一次繊毛の欠損や退縮による肥満発症はラットと同様にヒトでも起こると考えられます。本研究の結果に照らせば、バーデット・ビードル症候群の肥満の発症に視床下部ニューロンのMC4R局在一次繊毛の欠損が寄与すると考えられます。今後、ヒトの加齢性肥満のメカニズムを追究するため、本研究においてラットで発見した加齢に伴うMC4R局在一次繊毛の退縮がヒトでも起こっているのかを検証する研究が必要です。
本研究グループは今回、一次繊毛が加齢に伴って退縮する現象を世界で初めて発見しました。加齢に伴う退縮は他の一次繊毛でも起こっている可能性があり、様々な疾患の発症の原因になっている可能性があります。今後、加齢による一次繊毛の構造の変化がどのような分子メカニズムで起こるのかを解明することにより、退縮を防ぐ医薬品の開発への展開が期待されます。また、MC4Rを持つ一次繊毛が退縮して飽食シグナルに対する感度を低下させることには何らかの重要な生理的意義があると考えられ、それを解明する基礎研究も今後必要です。
また本研究では、MC4R局在一次繊毛の退縮を抑制する方法として、摂餌制限や遺伝子操作手法を見出しました。特に、加齢によって失われてしまったMC4R局在一次繊毛が摂餌制限によって再生したことは、肥満の治療に大きな希望を与える実験結果です。肥満は糖尿病など様々な生活習慣病(肥満症)の入口になる病態です。本研究グループは今後、得られた知見をもとに、生活習慣病を未病の段階で検出し、発症を予防する技術の開発や、肥満の根本的な治療法の開発につなげていきたいと考えています。
4.用語説明
*1 メラノコルチン4型受容体(MC4R)遺伝性肥満の原因遺伝子として知られる受容体。MC4Rは、飽食シグナルの伝達分子であるメラノコルチンを受容すると、自らが発現するニューロンの神経伝達活動を活性化することで神経回路を作動させ、全身の代謝や熱産生を促進するとともに食欲を抑制し、抗肥満作用を生み出す(図1参照)。
*2 一次繊毛
細胞外に突き出ている不動性の繊毛。がん細胞や血球以外のほとんど全ての正常細胞に存在する。近年、ニューロンが一次繊毛を持つことが知られるようになった。各ニューロンが1本ずつ持ち、アンテナとして機能する一次繊毛には様々な受容体が存在し、脳内を流れる多様な液性因子を受容していると考えられている。
*3 レプチン抵抗性
体内の白色脂肪細胞からレプチンが血中に分泌されているにもかかわらず、標的臓器でのレプチンの作用が低下している状態のこと。レプチンの抗肥満作用が得られないため、肥満が進行し、様々な生活習慣病につながるリスクが高まる。レプチン抵抗性は肥満治療における大きな問題だが、それが生じるメカニズムは不明であった。
*4 視床下部室傍核
視床下部を構成する神経核の1つ。第三脳室の左右に一対存在する。オキシトシン、バソプレシンなど様々なホルモンを持つニューロンが存在し、様々な生体調節機能に関わるが、MC4Rは食欲の調節に関わるニューロンに発現する。
*5 視床下部背内側部
視床下部を構成する神経核の1つ。室傍核よりも後部の第三脳室の左右に一対存在する。本研究により、MC4Rを発現するニューロンが延髄の中継領域に信号を伝達して交感神経系を活性化し、褐色脂肪組織という特殊な脂肪組織において脂肪の燃焼つまり熱の産生を促進することが明らかになった。この熱産生反応は全身の代謝量の増加につながる抗肥満反応である。
*6 MC4R-Cre ノックインラット
ノックインとは、染色体上の狙ったDNA配列の場所に、特定の配列を導入したり置き換えたりする技術のこと。本研究ではMC4R遺伝子の下流にDNA組み換え酵素であるCreの配列を導入したラットを作製した。このラットでは、MC4Rを発現する細胞でのみCreを発現する。
*7 アデノ随伴ウイルス
外部から標的の神経細胞に目的の遺伝子やRNAを発現させるために用いたウイルス。病原性がないため安全性が高く、遺伝子治療にも用いられる。本研究ではMC4R-Cre ノックインラットの脳の視床下部内にアデノ随伴ウイルスを微量注入することにより、MC4Rを発現するニューロン選択的に遺伝子発現抑制のためのRNAを発現させた。
*8 Zucker fatty 変異ラット
レプチン受容体遺伝子の変異により、レプチンによるシグナル伝達が障害されているラット。生後3週齢ごろから外観で区別がつくほど肥満を呈し始める。1961年にZuckerらによって突然変異体として発見された。
5.支援・謝辞
本研究は、国立研究開発法人科学技術振興機構(JST)(ムーンショット型研究開発事業)、国立研究開発法人日本医療研究開発機構(AMED)(老化メカニズムの解明・制御プロジェクト(研究課題名:体温と代謝の中枢調節機構の加齢変容と病態発現のメカニズム)、革新的先端研究開発支援事業(CREST)(研究課題名:精神ストレス反応制御技術を用いたストレス性循環器疾患発症メカニズムの解明))、日本学術振興会科学研究費助成事業(新学術領域研究「温度生物学」、基盤研究(A、B、C)、若手研究(B)、先端モデル動物支援プラットフォーム)、日本学術振興会特別研究員事業(RPD)、名古屋大学動物実験支援センター、名古屋大学大学院医学系研究科付属医学教育研究支援センター分析機器部門の支援を受けて行われました。6.ムーンショット型研究開発事業について
研究開発プログラム:ムーンショット目標2「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現」
(プログラムディレクター: 祖父江 元 愛知医科大学 理事長・学長)
研究開発プロジェクト名:「恒常性の理解と制御による糖尿病および併発疾患の克服」
(プロジェクトマネージャー:片桐 秀樹 東北大学 大学院医学系研究科 教授)
研究開発課題名:「中枢における情動—自律神経連関の神経回路解明とその制御法の開発」
(課題推進者:中村 和弘 名古屋大学 大学院医学系研究科 教授)
研究開発期間:令和2年12月~令和7年11月
研究開発プログラムでは、超早期疾患予測・予防を実現するため、観察・操作・計測・解析・データベース化など様々な研究開発を推進し、これらを統合して臓器間ネットワークの包括的な解明を進めていきます。
研究開発プロジェクトでは、AI・数理モデル解析などを活用して、代謝・循環の調節に重要である自律神経を介した臓器間ネットワークの機序を包括的に解明し、その制御手法を開発し、未病期段階の状態をより精密に検出します。それにより、2050年には、糖尿病および併発疾患の発症を未然に防ぐ社会の実現を目指します。
・プロジェクトマネージャーのコメント:
神経細胞の一次繊毛にMC4Rが局在し、その長さが個体でのエネルギー代謝制御に重要であるという生理的な意義の解明に加え、加齢や過栄養によりそれが短縮することが肥満につながることが明らかとなり、肥満や糖尿病を未病段階から改善する手法の開発につながる画期的な成果であり、本ムーンショット型研究開発事業の目標達成に大きく貢献するものである。
論文情報
雑誌名:Cell Metabolism論文タイトル:Age-related ciliopathy: obesogenic shortening of melanocortin-4 receptor-bearing neuronal primary cilia
著者名・所属名:Manami Oya,1 Yoshiki Miyasaka,2 Yoshiko Nakamura,1
Miyako Tanaka,3,4,5 Takayoshi Suganami,3,4,5,6 Tomoji Mashimo,2,7,8
and Kazuhiro Nakamura1
1Department of Integrative Physiology, Nagoya University Graduate School of Medicine(名古屋大学大学院医学系研究科・統合生理学分野)
2Institute of Experimental Animal Sciences, Graduate School of Medicine, Osaka University(大阪大学医学部・附属動物実験施設)
3Department of Molecular Medicine and Metabolism, Research Institute of Environmental Medicine, Nagoya University(名古屋大学環境医学研究所・分子代謝医学分野)
4Department of Immunometabolism, Nagoya University Graduate School of Medicine(名古屋大学大学院医学系研究科・免疫代謝学)
5Institute of Nano-Life-Systems, Institutes of Innovation for Future Society, Nagoya University(名古屋大学ナノライフシステム研究所・未来社会創造機構)
6Center for One Medicine Innovative Translational Research (COMIT), Nagoya University(名古屋大学One Medicine創薬シーズ開発・育成研究教育拠点)
7Division of Animal Genetics, Laboratory Animal Research Center, The Institute of Medical Science, The University of Tokyo(東京大学医科学研究所実験動物研究施設・先進動物ゲノム研究分野)
8Division of Genome Engineering, Center for Experimental Medicine and Systems Biology, The Institute of Medical Science, The University of Tokyo(東京大学医科学研究所システム疾患モデル研究センター・ゲノム編集研究分野)
DOI: 10.1016/j.cmet.2024.02.010
URL: https://www.sciencedirect.com/science/article/pii/S1550413124000561?via%3Dihub
連絡先
【研究者連絡先】名古屋大学 大学院医学系研究科 統合生理学分野
教授 中村 和弘(なかむら かずひろ)
https://www.med.nagoya-u.ac.jp/physiol2/KNpersonal.html
【JST事業連絡先】
科学技術振興機構 ムーンショット型研究開発事業部
https://www.jst.go.jp/moonshot/
【報道連絡先】
名古屋大学 医学部・医学系研究科 総務課総務係
https://www.nagoya-u.ac.jp/
大阪大学 大学院医学系研究科 広報室
https://www.med.osaka-u.ac.jp/
東京大学医科学研究所 プロジェクトコーディネーター室(広報)
https://www.ims.u-tokyo.ac.jp/
科学技術振興機構 広報課
https://www.jst.go.jp/
