| 発表のポイント |
|---|
|
研究の概要
大阪市立大学大学院医学研究科 ゲノム免疫学の植松智教授(東京大学医科学研究所附属ヒトゲノム解析センター メタゲノム医学分野 特任教授、附属国際粘膜ワクチン開発研究センター 自然免疫制御分野 特任教授を兼務)、藤本康介助教(東京大学医科学研究所附属ヒトゲノム解析センター メタゲノム医学分野 特任助教、附属国際粘膜ワクチン開発研究センター 自然免疫制御分野 特任助教を兼務)、東京大学医科学研究所附属ヒトゲノム解析センター 健康医療インテリジェンス分野の井元清哉教授らの研究グループは、ブリガム・アンド・ウィメンズ病院のJessica Allegretti博士を中心とする研究チームと国際共同研究を行い、再発性Clostridioides difficile関連腸炎患者の糞便移植治療の前後およびドナー糞便の腸内細菌叢と腸内ウイルス叢を詳細に解析しました。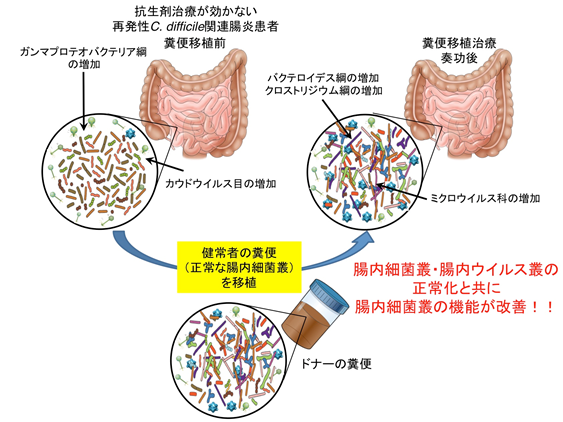
本研究の概要
本研究グループは、糞便移植治療が乱れていた腸内細菌と腸内ウイルスの構成比や感染関係を劇的に変化させるだけでなく、腸内細菌叢の機能回復にもつながることを示しました。
本研究成果は2月9日(日本時間)に国際科学雑誌『Gastroenterology』(IF=17.373)にオンライン掲載されました。
※1 糞便移植治療…健康な人の糞便に含まれている腸内細菌(乱れていない腸内細菌)を病気の患者に投与する治療法です。欧米を中心に行われている治療法で、特に再発性C. difficile関連腸炎に対して非常に有効だと報告されています。健康な人の糞便を生理食塩水で懸濁し、濾過した後、内視鏡を用いて腸管内に散布します。
研究の背景
消化管内には細菌やウイルスをはじめとした常在微生物叢が存在し、私たちの健康に大きな影響を与えています。次世代シークエンサー※2をはじめとしたゲノム解析技術の進歩に伴い、常在微生物叢解析が盛んに行われるようになりました。特に、腸内細菌叢の乱れと疾患(肥満、糖尿病、関節リウマチ、炎症性腸疾患など)との関係性が明らかとなり、乱れた腸内細菌叢を是正することで治療につなげようとする研究が世界中で進められています。C. difficileは健康な人の腸管にも常在している菌の一つで、普段はおとなしくしています。さまざまな感染症の治療に抗菌薬は有用ですが、広域スペクトルの抗菌薬が使われて正常な腸内細菌叢が破壊されると、C. difficileは増殖し2種類の毒素を出して発熱や下痢を主症状としたC. difficile関連腸炎が起こることがあります。
国内では、使用していた抗菌薬を中止し、C. difficileに感受性を持つバンコマイシンやメトロニダゾールといった抗菌薬の投与によって改善を認めることが多いとされています。ところが、欧米ではC. difficileの強毒株の出現や抗菌薬に対する耐性化などにより、治療がうまくいかなかったり、再発したりするケースが多数報告されています。そのような場合には、糞便移植治療が非常に有効だと報告されています。
糞便移植治療は、国内ではまだ臨床研究が進められている状況ですが、欧米では既に治療ガイドラインに取り入れられている治療法です。しかし、再発性C. difficile関連腸炎の改善に伴って、腸内細菌やウイルスの構成が変化することは知られているものの、その機能の変化についてはこれまでほとんど明らかとはなっていませんでした。
※2 次世代シークエンサー…遺伝子の配列を高速に読み出せる装置で、圧倒的に短時間かつ低コストでゲノム解析をすることが可能。
発表の内容
本研究では、米国ボストンのブリガム・アンド・ウィメンズ病院で糞便移植治療が奏功した再発性C. difficile関連腸炎患者9例およびそのドナーの糞便サンプルから腸内細菌ゲノムと腸内ウイルスゲノムを抽出し、それぞれ全ゲノムシークエンスを行いました。昨年報告した腸内細菌と腸内ウイルスの解析パイプライン※3を用いてその構成割合と感染関係の解析を行いました。糞便移植治療前のサンプルでは抗菌薬の使用に伴った腸内細菌叢の乱れが起こり、ガンマプロテオバクテリア綱の細菌が増加すると共に、カウドウイルス目のウイルスが増加していました。一方、治療後のサンプルでは、バクテロイデス綱・クロストリジウム綱の細菌とミクロウイルス科のウイルスの増加していました(図1)。また、治療後の腸内細菌叢およびウイルス叢はドナーの腸内細菌叢およびウイルス叢に近づいていることもわかりました。
※3 Cell Host & Microbe 2020 Sep 9;28(3):380-389.e9.
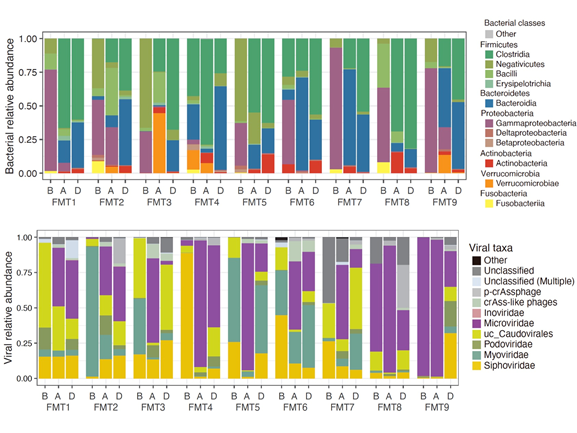
図1:9例の腸内細菌叢(上段)とウイルス叢(下段)の構成比
さらに今回得られたシークエンスデータを用いて、腸内細菌叢の機能解析を行いました。糞便移植治療前では、炎症と関連するフルオロ安息香酸分解経路が特徴的に認められ、移植前で増加し移植後に消失したガンマプロテオバクテリア綱の細菌がこの経路に関わっていることが明らかになりました。
移植後では、腸内細菌叢はドナーの構成比に近づいただけでなく、ドナーの腸内細菌叢が持つ機能に近づく(腸内細菌叢の機能が回復している)ことが明らかとなりました。アルギニンおよびオルニチン代謝経路、2次胆汁酸合成経路が糞便移植治療後で特徴的であり、機能の回復によって病態の改善に繋がっていることが分かりました。以上のことから、再発性C. difficile関連腸炎における病態形成に関わる菌群や、腸内細菌叢の機能回復に重要な菌群、遺伝子が明らかになりました。
期待される効果
米国では強毒株のC. difficileが出現しており、再発性C. difficile関連腸炎は国際的な社会問題となっています。今後、日本においてもそのリスクは増大すると考えられます。治療が非常に難しい再発性C. difficile関連腸炎に対して、糞便移植治療は非常に効果的であり期待される治療法の一つです。
しかしながら、移植に用いるドナーの糞便に関して、未だ「正常である」という定義ができていないため安全性が非常に危惧されています。そのため、近親者をドナーとすることが多く、治療法としてはとても限定的なものとなっています。
さらに、多剤耐性大腸菌を移植され死亡した例が2019年に複数報告され、現在糞便移植治療法の改善が強く望まれています。今回の一連の解析により、再発性C. difficile関連腸炎において治療標的とする菌の同定ならびに腸内細菌叢の回復機構が明らかになりました。本研究は、今後の糞便移植治療の改善や代替治療の開発への大きな一歩に繋がります。
研究者からのひとこと
藤本康介助教(東京大学医科学研究所附属ヒトゲノム解析センター メタゲノム医学分野 特任助教、附属国際粘膜ワクチン開発研究センター 自然免疫制御分野 特任助教を兼務)のコメント
「再発性C. difficile関連腸炎に対する糞便移植治療の有効性のエビデンスが多数報告されてきた一方で、糞便移植治療が奏功する詳細なメカニズムは明らかではありませんでした。ゲノム解析技術を駆使することで、腸管内の細菌・ウイルスの相対割合の変化だけでなく、細菌叢の機能回復が起こっていることを突き止めることができました」
資金・特許等について
本研究は、武田科学振興財団研究助成、キヤノン財団研究助成、JST COI STREAM東京大学V1拠点「自分で守る健康社会」、HPCI戦略プログラム 分野1「予測する生命科学・医療および創薬基盤」の一環として行われました。
発表雑誌
雑誌名:Gastroenterology (IF=17.373)
論文タイトル:Functional Restoration of Bacteriomes and Viromes by Fecal Microbiota Transplantation
著者:
Kosuke Fujimoto1,2,3, Yasumasa Kimura4, Jessica R Allegretti5, Mako Yamamoto6, Yao-zhong Zhang6, Kotoe Katayama6, Georg Tremmel7, Yunosuke Kawaguchi1, Masaki Shimohigoshi1, Tetsuya Hayashi1, Miho Uematsu1, Kiyoshi Yamaguchi8, Yoichi Furukawa8, Yutaka Akiyama9, Rui Yamaguchi7, Sheila E. Crowe10, Peter B. Ernst11,12,13, Satoru Miyano7, Hiroshi Kiyono11,12,14,15, Seiya Imoto6,16* and Satoshi Uematsu1,2,3,16* (*責任著者)
【所属】
1Department of Immunology and Genomics, Osaka City University Graduate School of Medicine
2Division of Metagenome Medicine, Human Genome Center, The Institute of Medical Science, The University of Tokyo
3Division of Innate Immune Regulation, International Research and Development Center for Mucosal Vaccines, The Institute of Medical Science, The University of Tokyo
4Division of Systems Immunology, The Institute of Medical Science, The University of Tokyo
5Division of Gastroenterology, Hepatology, and Endoscopy, Department of Medicine, Brigham and Women’s Hospital
6Division of Health Medical Intelligence, Human Genome Center, The Institute of Medical Science, The University of Tokyo
7Laboratory of DNA Information Analysis, Human Genome Center, The Institute of Medical Science, The University of Tokyo
8Division of Clinical Genome Research, The Institute of Medical Science, The University of Tokyo
9Department of Computer Science, Tokyo Institute of Technology
10Department of Medicine, University of California, San Diego
11Division of Gastroenterology, Department of Medicine, CU-UCSD Center for Mucosal Immunology, Allergy and Vaccines, University of California San Diego
12Division of Comparative Pathology and Medicine, Department of Pathology, University of California San Diego
13Center for Veterinary Sciences and Comparative Medicine, University of California, San Diego
14Department of Mucosal Immunology, IMSUT Distinguished Professor Unit, The Institute of Medical Science, The University of Tokyo
15International Research and Development Center for Mucosal Vaccines, The Institute of Medical Science, The University of Tokyo
16Collaborative Research Institute for Innovative Microbiology, The University of Tokyo
DOI:10.1053/j.gastro.2021.02.013
URL:https://www.gastrojournal.org/article/S0016-5085(21)00400-5/fulltext
問い合わせ先
〈研究に関すること〉東京大学医科学研究所 附属ヒトゲノム解析センター メタゲノム医学分野
(附属国際粘膜ワクチン開発研究センター 自然免疫制御分野 兼務)
特任助教 藤本 康介(ふじもと こうすけ)
https://www.ims.u-tokyo.ac.jp/imsut/jp/lab/hgclink/page_00083.html
〈報道に関すること〉
東京大学医科学研究所 国際学術連携室(広報)
https://www.ims.u-tokyo.ac.jp/imsut/jp/
