| 発表のポイント |
|---|
|
概要
インフルエンザウイルスのM2タンパク質やPB1-F2タンパク質は炎症反応に関わることが知られています。しかし、これらのウイルスタンパク質がどのように炎症反応を引き起こしているのか、その詳細なメカニズムは不明でした。東京大学医科学研究所感染症国際研究センターウイルス学分野の一戸准教授らの研究グループは、インフルエンザウイルスを感染させたマクロファージでは、核やミトコンドリア由来のDNAが細胞質中やマクロファージ細胞外トラップと呼ばれるネット状の構造物中に多く検出できることを見出しました。これらのDNAには酸化DNAが含まれており、インフルエンザウイルスの複製に必須のM2タンパク質(※1)が酸化DNAの放出を引き起こしていることを明らかにしました。またミトコンドリア内に局在するPB1-F2タンパク質(※2)は、ウイルスRNA存在下で酸化DNAの放出を誘導しました。
核やミトコンドリア由来と考えられるこれらの酸化DNAは、NLRP3(※3)やAIM2インフラマソーム(※4)依存的なIL-1β(※5)の産生を誘導しており、これがウイルス感染局所の炎症応答に関わっていることが示唆されました。
M2タンパク質のようなイオンチャネル活性を持つウイルスタンパク質は新型コロナウイルスを含む他のウイルスにも認められることから、本研究成果はインフルエンザウイルスだけでなく、新型コロナウイルスなどの強い炎症反応を引き起こすウイルスの病原性発現機構の解明にも繋がると期待されます。
本研究は日本学術振興会特別研究員事業などの一環として、また先進医薬研究振興財団および東京生化学研究会の助成を受けて得られたものです。研究成果は2020年6月15日の米国の科学雑誌「iScience」のオンライン版に公開されました。
研究内容
インフルエンザウイルスのM2タンパク質は、細胞内イオンバランスを変化させることによりNLRP3インフラマソーム依存的なIL-1βの産生を誘導します。またインフルエンザウイルスのPB1-F2タンパク質は、ミトコンドリア由来活性酸素種(ROS)依存的にNLRP3インフラマソームを活性化させることが報告されています。しかし、これらのウイルスタンパク質がどのようにNLRP3インフラマソームを活性化させているのか、その詳細なメカニズムは不明でした。研究グループは、インフルエンザウイルスを感染させたマクロファージでは、核やミトコンドリア由来のDNAが細胞質中やマクロファージ細胞外トラップと呼ばれるネット状の構造物中に多く検出できることを見出しました(図1)。これらのDNAには酸化DNAが含まれていることも分かりました。
インフルエンザウイルスが酸化DNAを誘導するメカニズムを解析したところ、インフルエンザウイルスのM2タンパク質はそれ単独で、PB1-F2タンパク質はウイルスRNA存在下で酸化DNAを誘導することを突き止めました。インフルエンザウイルスを感染させたマクロファージに酸化DNAを加えるとIL-1βの産生が増加し、これはNLRP3特異的な阻害剤で抑制されたことから、インフルエンザウイルスが誘導する酸化DNAはNLRP3インフラマソーム依存的なIL-1βの産生を増幅させていることが示唆されました。
また細胞内DNAセンサーとして機能するAIM2を欠損したマクロファージでは、野生型のマクロファージと比較してインフルエンザウイルス感染後のIL-1βの産生が有意に低下したことから、インフルエンザウイルスが誘導する核またはミトコンドリア由来DNAは、AIM2インフラマソーム依存的なIL-1βの分泌を促進させていることが示唆されました。
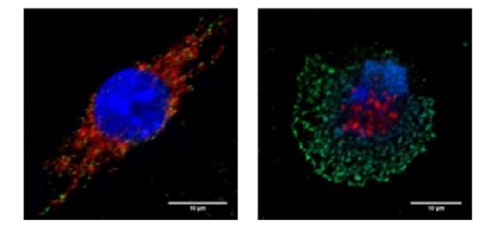
図1 インフルエンザウイルスを感染させる前(左)と感染24時間後のマクロファージ(右)
右下の白い棒の長さ10㎛。
本研究成果は、未解明であったインフルエンザウイルスM2タンパク質やPB1-F2タンパク質によるNLRP3インフラマソームの活性化機構を明らかにしただけでなく、DNAウイルスの細胞内センサーとして機能するAIM2インフラマソームがRNAウイルスであるインフルエンザウイルスの感染時にも重要な役割を果たしていることを示した重要な知見です。
これまでの常識ではRNAウイルスであるインフルエンザウイルスの感染には、細胞内のRNAセンサーが重要な役割を果たしていると考えられてきましたが、今後はDNAセンサーの役割についても考慮する必要があります。これらの知見を活かして、今後は新型コロナウイルスが強い炎症反応を引き起こすメカニズムの解析にも取り組むことにより、新型コロナウイルスがサイトカインストーム(※注6)などによりヒトで重症化するメカニズムの解明を目指します。
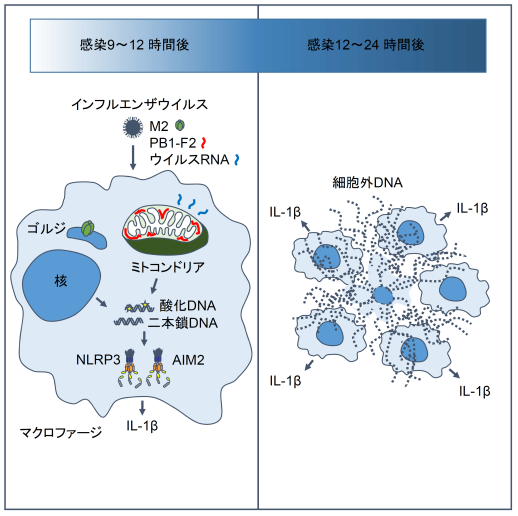
図2 本研究成果のまとめ
発表雑誌
雑誌名:「iScience」6月15日オンライン版論文タイトル:Influenza virus-induced oxidized DNA activates inflammasomes
著者:森山美優、長井みなみ、丸鶴雄平、小柴琢己、川口 寧、一戸猛志
URL:https://doi.org/10.1016/j.isci.2020.101270
用語解説
(※1)M2タンパク質プロトンチャネルとして機能することによりインフルエンザウイルスの増殖に必須のウイルスタンパク質である一方、ウイルスが細胞に感染したときの炎症反応を引き起こす原因となる。研究グループはこれまでにインフルエンザウイルスのM2タンパク質がNLRP3 インフラマソーム依存的なIL-1βの分泌(炎症反応)に必要であることを示している。↑
【参考】2013年10月14日プレスリリース「インフルエンザウイルス感染によって起こる
炎症反応のメカニズムを解明」
http://www.ims.u-tokyo.ac.jp/ichinohe-lab/131016.pdf
(※2)PB1-F2タンパク質
インフルエンザウイルスがコードする90アミノ酸程度の短いペプチド。ミトコンドリア内に入り、ミトコンドリアを断片化させることにより、ウイルスに対する自然免疫応答を抑制している一方、ダメージを受けたミトコンドリアから酸化DNAを放出させている。↑
(※3)NLRP3インフラマソーム
NLRP3は、ウイルスや細菌、環境中の刺激物(シリカ、アスベストなど)によって活性化する細胞内の自然免疫受容体。活性化すると細胞内でNLRP3インフラマソームと呼ばれる巨大なタンパク質複合体を形成して、IL-1βの分泌を促進させる。↑
(※4)AIM2インフラマソーム
AIM2は、ウイルス由来の二本鎖DNAによって活性化する細胞内の自然免疫受容体。活性化すると細胞内でAIM2インフラマソームと呼ばれる巨大なタンパク質複合体を形成して、IL-1βの分泌を促進させる。↑
(※5)IL-1β
ウイルス感染局所の炎症反応に関わるサイトカイン。IL-1βは好中球に作用して、好中球細胞外トラップ(NETs: neutrophil extracellular traps)を誘導することも知られている。このNETsは重症COVID-19患者でしばしばみられる血栓の原因のひとつとして考えられている。↑
(※6)サイトカインストーム
ウイルス感染や薬剤投与などがきっかけで血中の炎症性サイトカイン(IL-1β, IL-6, TNFα)が異常に上昇し、その作用が全身に及ぶことにより多臓器不全などを引き起こす。サイトカイン産生のブレーキが効かずに、なぜサイトカインの異常な産生状態が起こるのか?ウイルス側や宿主側の要因は何か?など発症機序には不明な点が多い。↑
問い合わせ先
<研究に関すること>東京大学医科学研究所 感染症国際研究センター ウイルス学分野
准教授 一戸 猛志(いちのへ たけし)
<報道に関すること>
東京大学医科学研究所 国際学術連携室(広報)
東京大学医科学研究所
https://www.ims.u-tokyo.ac.jp/imsut/jp/index.html
