研究活動
研究内容
インフルエンザウイルス
- 新型インフルエンザウイルスの解析
- H5N1インフルエンザウイルスの病原性解析
- 海外におけるインフルエンザ流行状況調査
- 薬剤耐性インフルエンザウイルスの解析
- インフルエンザウイルス粒子形成機構の解析
- インフルエンザワクチンの開発
エボラウイルス
1. 新型インフルエンザウイルスの解析
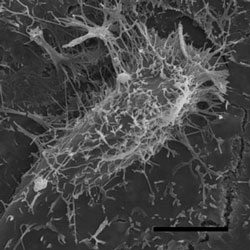
細胞表面からインフルエンザウイルスが出芽している。
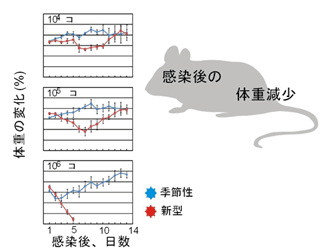
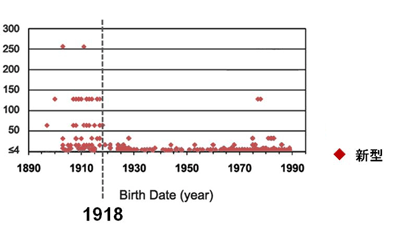
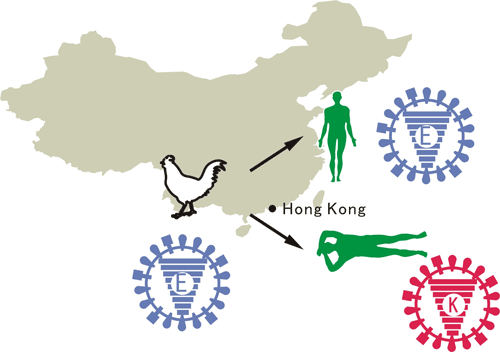
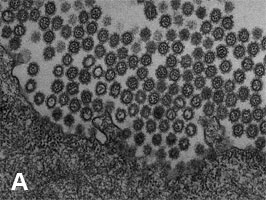
2009年3月に発生した豚由来の新型インフルエンザウイルス(Pandemic H1N1 2009)は、瞬く間に世界各地に拡がり、21世紀初のパンデミックを引き起こした。我々は、電子顕微鏡による形態解析(図1)や、動物実験による病原性解析(図2)などを行い、このウイルスの性状や病原性を明らかにした。また、日本人の新型ウイルス(Pandemic H1N1 2009)に対する抗体保有率調査を行い、1920年以降に生まれた人は、このウイルスに対する免疫がほとんどなかったことも明らかにした(図3)。新型ウイルス(Pandemic H1N1 2009)の流行状況調査等も行っている。
新型インフルエンザウイルスによるパンデミックは、これが最後ではない。今後、新たな亜型のウイルス(H5N1など)によるパンデミック発生の可能性も危惧されている。そのため、インフルエンザウイルスがパンデミックを起こすのに重要なウイルスの変異を解析し、新型ウイルス発生の可能性予測に役立つ情報も集積している。
2. H5N1インフルエンザウイルスの病原性解析
1997年以来、世界各地でH5N1高病原性鳥インフルエンザウイルスの人や動物への感染が報告されている。このH5N1ウイルスは人において約60%という高い致死率を示すが、その高病原性のメカニズムは未だ十分に明らかにされていない。そこで我々は,H5N1ウイルスの高病原性のメカニズムを解明することを目的として、動物モデルを用いて解析を行っている。ポリメラーゼ複合体の構成要素の一つであるPB2タンパク質の627番目のアミノ酸がリジン(K)であるウイルス株はマウスおよびフェレットにおいて病原性が高く、627番目のアミノ酸がグルタミン酸(E)である株は病原性が低いことを見出した。また627番目のアミノ酸がLysであると、鳥インフルエンザウイルスは哺乳動物において効率よく増殖することを明らかにした。我々はこのような病原性決定因子を複数見出しており、それらの因子がどのようなメカニズムでH5N1ウイルスの高病原性に関与しているのかを、宿主応答との関係から探索中である。病原性という複雑な生命現象を分子レベルで解明することにより、ウイルス感染症の新たな概念の確立と新規治療法の開発が期待される。
(Hatta et al., Science, 2001)
3. 海外におけるインフルエンザ流行状況調査

東南アジアなどの発展途上諸国では、H5N1ウイルスは、すでにエンデミックとなっており、未だなお、その制圧の目途は立っていない。
私たちは、家禽類での調査はもちろん、ブタやヒトといった様々な動物種への、H5N1ウイルスの罹患の有無といった分子疫学的調査を目的として、H5N1ウイルスが根づいてしまったベトナムやインドネシアなどの国々において、様々なチームと共同研究を行っている。
サーベイランスにより得られた、様々な動物種の検体を用いて、血清学的調査やウイルス分離、また、その遺伝子配列決定や分子発生学的系統解析を行うことにより、ウイルスの起源や進化について研究している。こうして得られた知見は、H5N1ウイルス制圧のための流行地域の把握に留まらず、効果的なワクチンの開発、ウイルスの高病原性に関与する変異や、薬剤耐性変異の獲得の有無などの把握といった、広範囲に渡る分野へと還元されている。

4. 薬剤耐性インフルエンザウイルスの解析
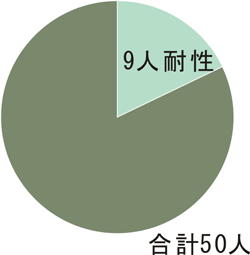
(Kiso et al. Lancet, 2005)
インフルエンザ患者での薬剤耐性ウイルス出現は、薬剤感受性低下に伴う臨床症状の悪化の懸念と共に、一般社会への流行、そして蔓延といった公衆衛生学的な面から社会に与える影響は非常に大きい。
インフルエンザ治療に用いる抗ウイルス薬は、M2阻害薬であるアマンタジン、ノイラミニダーゼ阻害薬であるオセルタミビルとザナミビルがある。アマンタジンは耐性ウイルスが非常に出現しやすく、実際、世界中の季節性インフルエンザウイルスの90%以上がアマンタジン耐性であり、2003年以後、臨床現場では使用が控えられている。一方、ノイラミニダーゼ阻害薬であるオセルタミビルとザナミビルは、インフルエンザウイルス表面に存在するノイラミニダーゼを阻害することにより、ウイルス増殖を抑制する。これまで、ノイラミニダーゼ阻害薬は耐性ウイルスが出現しにくい、というのが定説であった。私たちは季節性インフルエンザウイルスをはじめ、ヒト由来H5N1ウイルス、新型インフルエンザウイルス等におけるノイラミニダーゼ阻害薬耐性ウイルスについて、出現状況、ヒトからヒトへの伝播確認、病原性の調査等を行い、最善の薬剤による抗インフルエンザ対策を探求している。
5. インフルエンザウイルス粒子形成機構の解析
インフルエンザウイルスが持つ特徴として、そのゲノム構造が挙げられる。A型インフルエンザウイルスのゲノムは独立した8種類の分節に分かれたRNA(vRNA)で構成され、各vRNAは1ないし2個の異なるウイルス蛋白質遺伝子をコードする。それらvRNAから産生される全ての蛋白質は効率的なウイルス増殖に必須であることが解っている。したがって、ウイルスは増殖を繰り返すためには8種類のvRNAからなる完全なゲノムを常に維持することが必要である。
各vRNAは、両末端の12塩基と13塩基の相補的な配列とその内側の分節特異的な非コード領域、そして蛋白質コード領域に区別される一次構造を持つ。両末端の相補的な配列はvRNA分子内で2本鎖を形成し、vRNAは環状構造をとなる。この環状のvRNAには、さらにRNA結合蛋白質である核蛋白質(NP)とRNA依存性RNAポリメラーゼのPB1、PB2、PA蛋白質複合体が結合し、転写と複製活性を持つRNA-核蛋白質複合体(RNP)を構築する。この機能的なRNPは8種類の分節において、RNA配列を除き同じ構造を持っていると考えられる。
我々の研究室は、2003年にリバース・ジェネティクス法を用いて、NA分節vRNAの一部領域が、そのRNPが効率よくウイルス粒子に取り込まれるために必須であることを初めて示した。そのRNA領域(パッケージング・シグナル)はvRNA両末端から蛋白質コード領域をも含んだ。この結果は、A型インフルエンザウイルスにおいて初めてパッケージング・シグナルをvRNA上に同定したことと、従来単なる蛋白質コード遺伝子と考えられてきたRNA領域がウイルス粒子形成においても何らかの機能を持つことを示すことにおいて、非常に意義深い成果であった。さらに我々は他の7分節vRNAに関しても同様にパッケージング・シグナルの存在を確認し、A型インフルエンザウイルスにおけるパッケージング・シグナルに依存したvRNAの粒子への取り込み機構の存在を提唱した。我々の同定したパッケージング・シグナルのRNA塩基配列は各vRNAにより異なる。したがって、パッケージング・シグナルは8種類のRNPが個別に認識される分子マーカーとなり、8種類のRNPを選択的に集合させて完全なゲノムを構築する機構の存在を強く示唆する。
8種類のRNPが選択的に集合してゲノムを構築する機構の存在は、電子顕微鏡を用いた観察結果からも支持された。出芽中または出芽直後の粒子を出芽方向に対して垂直方向で連続切片を作製したところ、ウイルス粒子内に幅~12nm、長さ130nmまでの長さの異なる8本の棒状構造物が、中心の1本が周囲7本に囲まれる位置関係で存在することが観察された(図9)。8本の棒状構造物の長さの違いは、vRNAの長さの違いと一致することから、この棒状構造物が8種類のvRNPと同一と考えられる。
これまでの研究成果に基づき、我々は、A型インフルエンザウイルスの8種類のRNPはvRNAのパッケージング・シグナルに依存して選択され、出芽するウイルス粒子に特定のゲノム構造を維持して取り込まれるとするモデルを提唱している(図10)。
これまでに発生したパンデミックの主要な原因の一つは、vRNAが交換され異なるゲノム構築により抗原シフトを引き起こした結果、新型インフルエンザウイルスが出現したことである。したがって、A型インフルエンザウイルスのゲノムの構築と粒子形成は単に細胞レベルで分子生物学的な問題ではなく、インフルエンザの流行にも影響を与える重要な問題と認識する必要がある。我々は、このウイルス粒子形成機構の解明に向けて、リバース・ジェネティクス法と電子顕微鏡解析を駆使して取り組む。


6. インフルエンザワクチンの開発
現行の季節性インフルエンザワクチンは、不活化スプリット抗原を皮下に注射することにより、ウイルスに対する特異IgG抗体を血中に誘導する。その結果、ウイルスの体内での拡がりが抑制され、患者が発症あるいは重症化するのを予防する。しかしながら、ウイルスの侵入門戸である上気道部に抗体はほとんど分泌されないため、感染自体を阻止することは困難である。一方、米国ですでに用いられている鼻腔噴霧型の弱毒生ワクチンは、上気道部にウイルスに特異的な分泌型IgA抗体が誘導されるため、ワクチン効果は高く感染予防が期待できる。しかしながら、ウイルスが増殖することによる副作用やワクチンウイルスの病原性復帰の可能性など安全面における問題が指摘され、この生ワクチンがわが国で使用される予定は今のところない。私たちは、不活化ワクチンの安全性と生ワクチンの高い効果を併せもつ新しい季節性インフルエンザワクチン(半生ワクチン)の開発に向けた基礎研究、さらに、高病原性H5N1ウイルスや新型H1N1ウイルスに対する新しいワクチン戦略の構築を推進している。
4種類のプラスミドのみのトランスフェクションでワクチンシードウイルスの作製が可能
(Neumann et al., PNAS)
7. エボラウイルスレセプターの探索
ウイルスの感染初期過程として細胞への吸着・細胞内への侵入・膜融合による脱殻というステップがある。これまでエボラウイルスの吸着に関わる宿主側の因子としてDC-SIGNなどのC型レクチンが同定されているが、C型レクチンを発現していない細胞への感染も認められることから他の未同定因子も吸着を担うと考えられる。侵入はエンドサイトーシスによるが、その具体的経路は分かっていない。近年、侵入後にカテプシンによるウイルス糖蛋白質(吸着・侵入・脱殻を担うウイルス蛋白質)のトリミングが起こることが示された。しかしながら、脱殻に関わる宿主因子は全く分かっていない。
我々はエボラウイルスの蛋白質発現系やシュードタイプウイルスを用い、質量分析・共焦点顕微鏡観察・各種阻害剤・発現クローニングなどの手法により本ウイルスの感染初期過程の解明、特に宿主側の関連因子の同定に取り組んでいる。
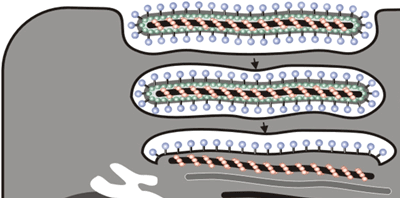
8. エボラウイルスの粒子形成機構の解析
フィロウイルス科に属するエボラウイルスの特徴は、フィロ(filo=糸状)の名前の由来通り、フィラメント状の粒子構造を形成することである。フィラメント状のウイルス粒子はエンベロープに包まれており、7種類の構造タンパク質から構成される。この特徴的なフィラメント状ウイルス粒子がどのように形成されるのかを明らかにするため、ウイルスタンパク質発現系を用いて、各構造タンパク質の機能を解析した。
NPはヌクレオカプシドの核となる構造を形成し、VP24とVP35とともにヌクレオカプシドを形成した。VP40は単独でフィラメント状粒子を形成し、GPとの共発現により、エボラウイルス様粒子を形成した(図13)。また、VP40はヌクレオカプシドの細胞内輸送だけでなくウイルス粒子内への取り込みに必要であることがわかった。細胞表面から出芽するとき、エボラウイルスは細胞膜から水平に浮上するようにウイルス粒子を形成し(図14)、細胞外へと放出されることがわかった。
現在、エボラウイルスタンパク質と相互作用する宿主因子の同定と、同定された宿主因子がウイルス増殖環で果たす役割について解析中である。
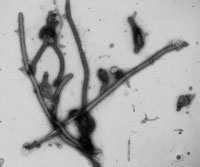
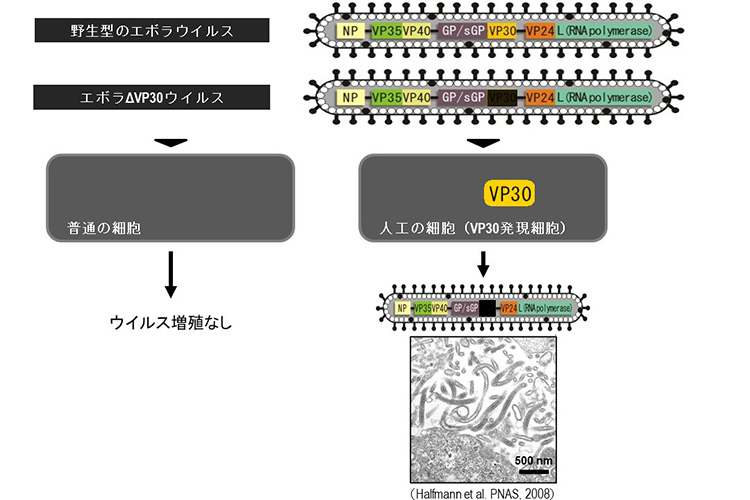
9. エボラΔVP30ウイルスシステムを用いた解析
我々はエボラウイルスの増殖に必須である転写活性化因子VP30を欠損させた変異エボラウイルスを作製した(図15)。このエボラΔVP30ウイルスは通常の細胞では増えることができないが、VP30タンパク質を発現する人工細胞(VP30発現細胞)では、野生型のエボラウイルスと同等にウイルスタンパク質合成やゲノム複製が行われ、効率よく増殖することができる。このΔVP30ウイルスはVP30発現細胞以外では増殖することができないため、安全性が高く、BSL-2実験室(米国ウィスコンシン大学)で扱うことができる。また、種々の細胞、組織、個体にVP30を発現させることで感染実験に用いることもできる。
我々はこのエボラΔVP30ウイルスシステムを用いて、ウイルス側因子の機能解析だけでなく、ウイルス側因子と相互作用する宿主因子を様々なスクリーニング手法により同定し、同定された宿主因子がエボラウイルスの増殖環(細胞内への侵入、転写及び複製、ウイルス粒子形成など)で果たす役割についての解析も行っている。加えて、我々はこのエボラΔVP30ウイルスのエボラワクチンへの応用開発と実用化に向けた臨床試験にも取り組んでいる。